В течение последних нескольких лет мы неоднократно предполагали, что отсутствие возможности точной количественной оценки форм колебаний давления потока является одной из наиболее существенных предпосылок для споров относительно выгод пульсирующей перфузии при проведении манипуляций на открытом сердце у педиатрических и взрослых пациентов [1-5]. Объем гемодинамической энергии, вырабатываемый разными типами пульсирующих насосов (перистальтических насосов и насосов с гидроприводом) при равной скорости потока в насосе и артериальном давлении, существенно различался [6, 7]. Количественная оценка форм колебаний давления пульсирующего и непульсирующего потоков с точки зрения пульсового давления неадекватна, потому пульсовое давление зависит от градиента энергии [1-5, 8, 9]. Мы уже демонстрировали, что при равном пульсовом давлении два разных пульсирующих насоса вырабатывали совершенно разный объем гемодинамической энергии [7]. Существует прямая корреляция между строением (форма и размер) форм колебаний и объемами гемодинамической энергии [7]. Формы колебаний с более физиологическим строением содержат больший объем гемодинамической энергии по сравнению с формами колебаний с менее физиологическим строением при идентичном пульсовом давлении и скорости потока в насосе [7]. Мы также доказали, что при наличии избытка гемодинамической энергии в контуре и теле пациента, перфузия жизненно важных органов в условиях пульсирующего кровотока существенно улучшалась [10-14].
Создание пульсирующего кровотока зависит от градиента энергии [1-5, 8, 9]. Избыток гемодинамической энергии(SHE) – это излишек гемодинамической энергии, вырабатываемый пульсирующим насосом после достижения необходимого уровня пульсового давления [8, 9, 15]. Целью настоящего исследования было выполнить точную количественную оценку и сравнить формы колебаний давления потока с точки зрения уровней избытка гемодинамической энергии у шести различных педиатрических аппаратов искусственного кровообращения на примере новорожденных поросят.
Материалы и методы
Тридцать девять поросят (средний вес особи 3 кг) подвергались искусственному кровообращению с помощью физиологического пульсирующего насоса с гидроприводом (PPP (physiologic pulsatile pump); 7 особей), с использованием пульсирующего перистальтического насоса Jostra-HL 20 (Jostra-PR; 6 особей), с использованием пульсирующего перистальтического насоса Stockert SIII (SIII-PR; 6 особей), с использованием установленного на мачте пульсирующего перистальтического насоса Stockert SIII с миниатюрной роликовой головкой (Mast-PR; 7 особей), с использованием установленного на мачте непульсирующего перистальтического насоса Stockert SIII (Mast-NP; 7 особей), а также с использованием непульсирующего перистальтического насоса Stockert CAPS (CAPS-NP, 7 особей).
Протокол анестезии и хирургический протокол были детально описаны в наших предыдущих публикациях [6, 10-14]. Всем животным было обеспечено гуманное отношение в соответствии сРуководство по содержанию и использованию лабораторных животных Национального научно-исследовательского совета (Guide for the Care and Use of Laboratory Animals of the National Research Council) (National Academy Press, редакция от 1996 г.). В отношении каждого поросенка была проведена медикаментозная подготовка к операции: внутримышечная инъекция кетамина гидрохлорида (20 мг/кг) и ацепромазина малеата (1 мг/кг). После постановки внутривенного катетера для механической вентиляции устанавливалась эндотрахеальная трубка диаметром 3 мм. Вводились внутривенные болюсы фентанила цитрата (100 мкг/кг) и панкурония бромида (0.3 мг/кг). После осуществления срединной стернотомии восходящая аорта и правое предсердие были канюлированы с помощью аортальной канюли 10F (DLP, Inc., Grand Rapids, MI) и одноступенчатой венозной канюли 21F (Polystan A/S, Varlose, Denmark) соответственно. Экстракорпоральный контур был наполнен свежей гепаринизированной кровью и Рингера раствором лактатным. Объем раствора, потребовавшийся для заполнения всего контура, составил приблизительно 600 мл. В процессе искусственного кровообращения гематокрит поддерживался на уровне 20%. Во всех экспериментах применялись половолоконные мембранные оксигенаторы (Capiox SX10; Terumo Corp, Tokyo, Japan) и педиатрический артериальный фильтр (Terumo Corp). Во время пульсирующего искусственного кровообращения скорость работы насоса была равна 150 ударам в минуту, а ударный объем поддерживался на уровне 1 мл/кг. Напор в насосе во всех группах равнялся 150 мл•кг-1•мин-1. Ультразвуковой расходомер (T109; Transonic Systems, Inc., Ithaca, NY) для измерения кровотока был встроен в контур выше мембранного оксигенатора. Во время искусственного кровообращения среднее артериальное давление (MAP) поддерживалось на уровне 45 мм.рт.ст. посредством подачи изофлюрана через трубку притока газа оксигенатора. Показатели pH и pCO2 артериальной крови поддерживались на уровне 7.35-7.45 и 35-45 мм.рт.ст. соответственно. Кристаллоидная кардиоплегия (модифицированный раствор Кирклина (Kirklin solution)) в объеме 40 мл вводился вручную в восходящую часть дуги аорты в начале остановки кровообращения в условиях глубокой гипотермии (deep hypothermic circulatory arrest (DHCA)). В течение 60-минутного периода пережатия аорты температура поддерживалась на уровне 18°С в обеих группах. В конце каждого эксперимента поросенка подвергались эвтаназии посредством внутривенного болюсного введения пентобарбитала натрия и фенитоина натрия (Beuthanasia-D) в объеме 0.22 мг/кг.
План эксперимента
После запуска искусственного кровообращения каждое животное подвергалось 20 минутам гипотермии, 60 минутам остановки кровообращения в условиях глубокой гипотермии (DHCA), 10 минутам реперфузии холодной кровью и 40 минутам согревания. Во время охлаждения и согревания применялась кислотно-основная терапия alpha-stat. Во всех экспериментах за 5 минут до начала искусственного кровообращения использовались феноксибензамин (1 мг/кг), сильнодействующий вазодилататор и ?- адреноблокатор.
Напор в насосе поддерживался на уровне 150 мл•кг-1•мин-1, а среднее артериальное давление на уровне 45 мм.рт.ст. В экспериментах с пульсацией скорость работы насоса поддерживалась на уровне 150 ударов в минуту, а ударный объем на уровне 1 мл/кг.
Точная оценка формы колебаний давления пульсирующего и непульсирующего потоков
Избыток гемодинамической энергии(SHE) (эрг/см3) = 1,332 ([(? fpdt) / (? fdt)] – MAP) вычислялся на каждом этапе эксперимента (где MAP – среднее артериальное давление, f = напор в насосе, p = артериальное давление, а dt = приращение за определенное время).
Данные о формах колебаний давления в бедренной артерии (MAP), давлении в экстракорпоральном контуре до канюли и скорости работы насоса собирались на трех этапах эксперимента: 1) при нормотермическом искусственном кровообращении (через 15 минут после подключения к насосу при температуре 36°С); 2) при искусственном кровообращении в условиях глубокой гипотермии (сразу после остановки кровообращения в условиях глубокой гипотермии (deep hypothermic circulatory arrest (DHCA) при температуре 18°С) и 3) в период согревания (после 60 минут остановки кровообращения в условиях глубокой гипотермии (deep hypothermic circulatory arrest (DHCA), 10 минут реперфузии холодной кровью и 40 минут согревания).
Статистические методы
Линейная модель со смешанными эффектами, которая объясняет взаимосвязь между повторными экспериментами на животных, согласовывалась с данными для оценки избытка гемодинамической энергии (SHE) при использовании различных насосов и на разных этапах эксперимента. Межсубъектным фактором для данной модели был насос (PPP, Jostra PR, SIII-PR, Mast-PR, CAPS-NP и Mast-NP). Внутригрупповым фактором для модели стал этап эксперимента (нормотермическое искусственное кровообращение, этап пре-DHCA и пост-DHCA). Все значения p и доверительные интервалы для расчета стандартного отклонения при оценке SHE были адаптированы для парного сравнения с применением процедуры множественного сравнения Тьюки (Tukey). Все анализы проводились с использованием пакета программ для статистической обработки данных SAS (SAS Institute Inc., Cary, NC).
Результаты
Уровни избытка гемодинамической энергии (SHE) у поросят
При нормотермическом искусственном кровообращении физиологический пульсирующий насос производил максимальный объем избыточной энергии (8,563 ± 1,918 эрг/см3, p < 0.001). Среди всех остальных насосов, за исключением физиологического пульсирующего насоса, значительно больший объем избытка гемодинамической энергии произвели насос Jostra HL-20 (2731 ± 374 эрг/см3, p < 0.001) и пульсирующий перистальтический насос SIII (2,020 ± 441 эрг/см3, p < 0.001). Установленный на мачте пульсирующий перистальтический насос Stockert SIII с миниатюрной роликовой головкой произвел SHE ((–114 ± 911 эрг/см3) не больше непульсирующих насосов. Ни один из непульсирующих насосов не произвел избыточной энергии. Результаты, зафиксированные после нормотермического искусственного кровообращения и после DHCA и согревания, оказались весьма сходными с результатами, полученными во время нормотермического искусственного кровообращения. На рисунках 1-3 подробно отражены результаты эксперимента.
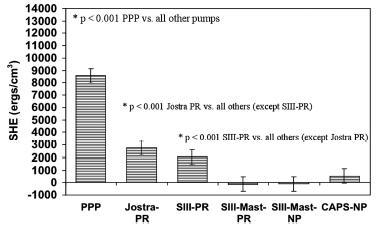
Рисунок 1 Объем избыточной гемодинамической энергии у поросят при нормотермическом искусственном кровообращении (средний объем ± SD)
*p<0.001 PPP против всех остальных насосов
*p<0.001 Jostra PR против остальных насосов (кроме SIII-PR)
*p<0.001 SIII-PR против остальных насосов (кроме Jostra PR)
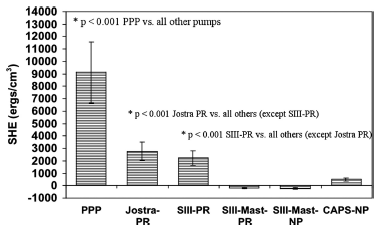
Рисунок 2 Объем избыточной гемодинамической энергии у поросят при искусственном кровообращении в условиях гипотермии (средний объем ± SD)
*p<0.001 PPP против всех остальных насосов
*p<0.001 Jostra PR против остальных насосов (кроме SIII-PR)
*p<0.001 SIII-PR против остальных насосов (кроме Jostra PR)
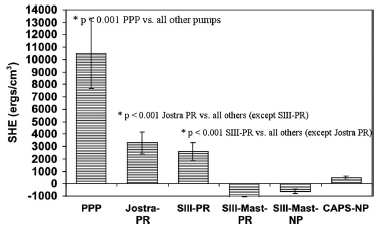
Рисунок 3 Объем избыточной гемодинамической энергии у поросят при искусственном кровообращении в условиях согревания (после 60 минут остановки кровообращения в условиях глубокой гипотермии (DHCA), 10 минут реперфузии холодной кровью и 40 минут согревания) (средний объем ± SD)
*p<0.001 PPP против всех остальных насосов
*p<0.001 Jostra PR против остальных насосов (кроме SIII-PR)
*p<0.001 SIII-PR против остальных насосов (кроме Jostra PR)
Уровни избытка гемодинамической энергии (SHE) в экстракорпоральных контурах
Уровни избытка гемодинамической энергии (SHE) в экстракорпоральных контурах были значительно выше аналогичных уровней у поросят на всех трех стадиях эксперимента. В то же время порядок с точки зрения выработки энергии полностью совпадал с картиной, полученной у поросят. При нормотермическом искусственном кровообращении физиологический пульсирующий насос производил значительно больший объем гемодинамической энергии, чем все остальные насосы (42,909 ± 11,996эрг/см3 ergs/cm3, p < 0.001). Пульсирующий перистальтический насос Jostra HL-20 показал второй результат по объему произведенной избыточной энергии (11,233± 2,836), а пульсирующий перистальтический насос SIII оказался третьим (7,726 1,757 эрг/см3). Установленный на мачте пульсирующий перистальтический насос Stockert SIII с миниатюрной роликовой головкой произвел SHE не больше непульсирующих насосов. На рисунках 4-6 подробно отражены результаты эксперимента.
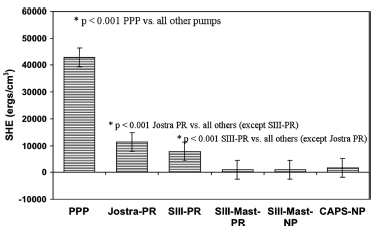
Рисунок 4 Объем избыточной гемодинамической энергии в экстракорпоральных контурах у поросят при нормотермическом искусственном кровообращении (средний объем ± SD)
*p<0.001 PPP против всех остальных насосов
*p<0.001 Jostra PR против остальных насосов (кроме SIII-PR)
*p<0.001 SIII-PR против остальных насосов (кроме Jostra PR)
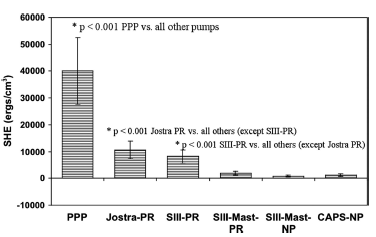
Рисунок 5 Объем избыточной гемодинамической энергии в экстракорпоральных контурах у поросят при искусственном кровообращении в условиях гипотермии (средний объем ± SD)
*p<0.001 PPP против всех остальных насосов
*p<0.001 Jostra PR против остальных насосов (кроме SIII-PR)
*p<0.001 SIII-PR против остальных насосов (кроме Jostra PR)
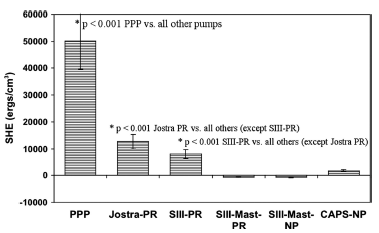
Рисунок 6 Объем избыточной гемодинамической энергии в экстракорпоральных контурах у поросят при искусственном кровообращении в условиях согревания (после 60 минут остановки кровообращения в условиях глубокой гипотермии (DHCA), 10 минут реперфузии холодной кровью и 40 минут согревания) (средний объем ± SD)
*p<0.001 PPP против всех остальных насосов
*p<0.001 Jostra PR против остальных насосов (кроме SIII-PR)
*p<0.001 SIII-PR против остальных насосов (кроме Jostra PR)
Обсуждение
Результаты нашего исследования несомненно доказывают, что формула расчета избытка гемодинамической энергии является новым средством точной количественной оценки форм колебаний давления при разных режимах перфузии и типах пульсации. Наши результаты также подтверждают тот факт, что не все пульсирующие насосы производят адекватный объем пульсирующей энергии. Фактически, один из пульсирующих перистальтических насосов вообще не произвел избыточной энергии. Вследствие этого крайне важно, чтобы исследователи проводили количественную оценку уровня гемодинамической энергии перед непосредственным сравнением различных режимов перфузии в свете восстановления рецепторов.
Что же происходит с этим избытком гемодинамической энергии, произведенным в результате адекватной пульсации? Мы подтвердили документально, что при наличии существенной разницы между режимами пульсации, восстановление жизненно важных органов существенно улучшалось в условиях пульсирующего кровотока [2, 3, 10-14]. В отсутствие разницы между уровнями гемодинамической энергии в разных режимах перфузии нарушение функции жизненно важных органов было схожим в обеих группах [16]. Таким образом, прослеживается прямая связь между уровнем избыточной гемодинамической энергии и восстановлением жизненно важных органов в условиях пульсирующего кровотока.
Каждый компонент экстракорпорального контура оказывает непосредственное влияние на качество пульсации [17-20]. В настоящем исследовании единственным различием между шестью группами была модель аппарата искусственного кровообращения (АИК). Все остальные составляющие экстракорпорального контура, включая мембранный оксигенатор и артериальный и венозный катетеры, были идентичными во всех шести группах. Все пульсирующие и непульсирующие насосы, использованные в исследовании, за исключением физиологического пульсирующего насоса, были одобрены для клинического использования Управлением по контролю за качеством пищевых продуктов медикаментов и косметических средств США. Физиологический пульсирующий насос производил наибольшее количество гемодинамической энергии на всех этапах эксперимента. Пульсирующие перистальтические насосы Jostra HL-20 и SIII производили только четверть от объема, вырабатываемого физиологическим пульсирующим насосом (PPP).
Единственным различием между формулами SHE (избытком гемодинамической энергии) и энергетического эквивалента давления (EEP) были единицы измерения. EEP измеряется в мм.рт.ст., а SHE в эрг/см3. Таким образом, формула расчета гемодинамической энергии точно отражает уровни гемодинамической энергии с точки зрения единиц измерения энергии. EEP измеряется в мм.рт.ст., что дает нам возможность сравнивать его со средним артериальным давлением (MAP). При наличии избыточной энергии EEP всегда будет выше MAP. Разница между EEP и MAP в избыточной энергии. Разница между EEP и MAP в здоровом человеческом сердце составляет около 10% [9]. Несколько исследователей адоптировали формулы расчета EEP и SHE для точной количественной оценки формы колебаний давления в условиях пульсирующей и непульсирующей перфузии при неотложной и хронической терапии [15, 21, 22].
Заключение
Формула расчета избытка гемодинамической энергии – это новый метод точной количественной оценки различных уровней пульсации и непульсации для прямых и обоснованных сравнений.
Физиологический пульсирующий насос произвел наибольший объем пульсирующей энергии. Большая часть педиатрических пульсирующих насосов (за исключением установленного на мачте пульсирующего перистальтического насоса Stockert SIII с миниатюрной роликовой головкой Mast-PR) производили значительное количество избыточной гемодинамической энергии. Ни один непульсирующий насос не вырабатывал достаточный объем избыточной гемодинамической энергии.
Библиография
1. ?ndar A, Rosenberg G, Myers JL: Majors factors in the controversy of pulsatile versus nonpulsatile flow during acute and chronic cardiac support [editorial]. ASAIO J 51: 173–175, 2005.
2. ?ndar A: Benefits of pulsatile flow during and after cardiopulmonary bypass procedures [editorial]. Artif Organs 29: 687–689, 2005.
3. ?ndar A: Myths and truths of pulsatile and non-pulsatile perfusion during acute and chronic cardiac support [editorial]. Artif Organs 28: 439–443, 2004.
4. ?ndar A: Principles and practices of pulsatile perfusion in pediatric and adult open-heart surgery. Turk J Thorac Cardiovasc Surg 12: 215–219, 2004.
5. ?ndar A: The ABCs of research on pulsatile versus nonpulsatile perfusion during cardiopulmonary bypass [editorial]. Med Sci Monit 8: ED21–ED24, 2002.
6. ?ndar A, Eichstaedt HC, Masai T, et al: Comparison of six pediatric cardiopulmonary bypass pumps during pulsatile and nonpulsatile perfusion. J Thoracic Cardiovasc Surg 122: 827–829, 2001.
7. ?ndar A, Masai T, Frazier OH, Fraser CD Jr: Pulsatile and nonpulsatile flows can be quantified in terms of energy equivalent pressure during cardiopulmonary bypass for direct comparisons. ASAIO J 45: 610–614, 1999.
8. Shepard RB, Simpson DC, Sharp JF: Energy equivalent pressure. Arch Surg 93: 730–740, 1966.
9. Wright G: Hemodynamic analysis could resolve the pulsatile blood flow controversy. Ann Thorac Surg 58: 1199–204, 1994.
10. ?ndar A, Masai T, Beyer EA, et al: Pediatric physiologic pulsatile pump enhances cerebral and renal blood flow during and after cardiopulmonary bypass. Artif Organs 26: 919–923, 2002.
11. ?ndar A, Masai T, Yang SQ, et al: Pulsatile perfusion improves regional myocardial blood flow during and after hypothermic cardiopulmonary bypass in a neonatal piglet model. ASAIO J 48: 90–95, 2002.
12. ?ndar A, Masai T, Yang SQ, et al: Effects of perfusion mode on regional and global organ blood flow in a neonatal piglet model. Ann Thorac Surg 68: 1336–1343, 1999.
13. ?ndar A, Eichstaedt HC, Frazier OH, Fraser CD: Monitoring regional cerebral oxygen saturation using near-infrared spectroscopy during pulsatile hypothermic cardiopulmonary bypass in a neonatal piglet model. ASAIO J 46: 103–106, 2000.
14. ?ndar A: Design and performance of physiologic pulsatile flow cardiopulmonary bypass systems for neonates and infants [PhD dissertation]. The University of Texas at Austin, May 1996.
15. ?ndar A, Zapanta CM, Reibson JD, et al: Precise quantification of pressure-flow waveforms of a pulsatile VAD during chronic support. ASAIO J 51: 56–59, 2005.
16. ?ndar A, Eichstaedt HC, Bigley JE, et al: Effects of pulsatile and nonpulsatile perfusion on cerebral hemodynamics investigated using a new pediatric pump. J Thorac Cardiovasc Surg 124: 413–416, 2002.
17. ?ndar A, Lodge AJ, Daggett CW, et al: The type of aortic cannula and membrane oxygenator affect the pulsatile waveform morphology produced by a neonate-infant cardiopulmonary bypass system in vivo. Artif Organs 22: 681–686, 1998.
18. Gourlay T, Gibbons M, Taylor KM: Pulsatile flow compatibility of a group of membrane oxygenators. Perfusion 2: 115–126, 1987.
19. ?ndar A, Koenig KM, Frazier OH, Fraser CD: Impact of membrane oxygenators on pulsatile versus nonpulsatile perfusion in a neonatal model. Perfusion 15: 111–120, 2000.
20. ?ndar A, Lodge AJ, Daggett CW, et al: Design and performance of a physiologic pulsatile flow neonate-infant cardiopulmonary bypass system. ASAIO J 42: M580–583, 1996.
21. Kim HK, Son HS, Fang YH, et al: The effects of pulsatile flow upon renal tissue perfusion during cardiopulmonary bypass: A comparative study of pulsatile and nonpulsatile flow. ASAIO J 51: 30–36, 2005.
22. Gu YJ, Dekroon TL, Elstrodt JM, et al: Augmentation of abdominal organ perfusion during cardiopulmonary bypass with a novel intra-aortic pulsatile catheter pump. Int J Artif Organs 28: 35– 43, 2005.