Выводы: Положительное влияние, оказываемое удалением цитокинов при септическом шоке может, хотя бы отчасти, быть дополнено защитой барьерных функций сосудистого русла.
Ключевые слова: сепсис, капиллярная утечка, проницаемость эндотелия, цитокины, экстракорпоральное удаление
Предпосылки
Сепсис – это угрожающая жизни дисфункция, обусловленная дисрегуляцией реакции организма на (зачастую локальную) инфекцию [1]. Большинство людей гибнут нет от инфекции как таковой, а, скорее, от (воспалительного) ответа своего организма на нее [2]. Иммунная система, несомненно, играет роль в развитии заболевания, и, вместе с тем, почти без внимания остается микроциркуляторное русло. Эндотелий выстилает каждый сосуд и отвечает за целый ряд физиологических функций, которые при сепсисе нарушаются [3]. Это приводит к тому, что при сепсисе эндотелий превращается в про-коагулянтное адгезионное покрытие, перестает синтезировать свои обычные сосудосуживающие и сосудорасширяющие соединения и не способен нормально выполнять барьерную функцию. Из всех этих изменений повышение проницаемости сосудов играет особую роль, так как провоцирует гиповолемию и способствует развитию гемоконцентрации, гемостаза и шока. Таким образом, системные изменения сосудов могут иметь тяжелые последствия для функционирования органов, напрямую способствуя ПОН [4]. Ранее сообщалось о способности цитокинов, таких, как TNFα, вызывать капиллярную утечку. Вместо изолированного рассмотрения работы иммунной системы и микроциркуляторного русла мы хотели глубже проанализировать комплексную взаимосвязь обеих систем в клиническом контексте. Для выполнения этой задачи мы использовали сыворотку крови пациента с сепсисом, взятую до и после удаления цитокинов, и протестировали ее влияние на морфологию и функции эндотелия in vitro.
Презентация клинического случая
Бригада скорой помощи обнаружила 32-летнюю женщину без сознания в состоянии гипоксии. 4 суток до этого у пациентки отмечалось плохое самочувствие, жар, кашель. Женщину успешно реанимировали и после начального лечения в местной больнице перевели в наш центр для проведения процедуры экстракорпоральной мембранной оксигенации (ЭКМО) ввиду пневмонии, вызвавшей дыхательную недостаточность и острый респираторный дистресс-синдром (ОРДС). Кроме того, в левой груди пациентки был обнаружен абсцесс с ростом Escherichia coli. Ввиду сепсиса (пик С-реактивного белка 222 мг/л; пик прокальцитонина 81.2 мкг/л) и развивающегося ОПП потребовалась дополнительная органная поддержка в виде постоянного вено-венозного гемодиализа (СVVHD). Оценка по шкале SOFA – 18 баллов; рефрактерная гипотензия (несмотря на антибиотики широкого спектра действия, адекватную водную нагрузку и высокие дозировки инотропов и катехоламинов). Необычная тяжесть септического шока указывала на мощный системный воспалительный ответ, связанный с массивным цитокиновым штормом, - подобная комбинация часто встречается у пациентов, переносящих токсический шок. Клинические и лабораторные показатели в динамике приведены в Таблице 1 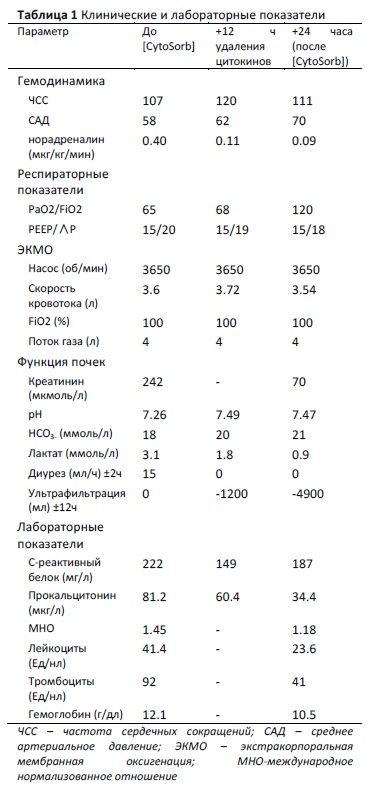 В дополнение для удаления избыточных концентраций цитокинов, поддерживающих шок, была проведена 1 сессия терапии с фильтром CytoSorb длительностью 24 часа. После этой сессии стало возможным удерживать среднее артериальное давление (САД) на уровне выше 65 мм рт.ст., значительно снизилась потребность в вазопрессорах, появилась возможность удалять избыточную жидкость с помощью ультрафильтрации. Изменения клинической картины свидетельствовали о прекращении сосудистых изменений, ранее способствовавших развитию и поддержанию шока (потеря давления и барьерных функций). К сожалению клинические и радиологические признаки тяжелого повреждения мозга заставили нас поменять терапевтическую стратегию и перейти симптоматической терапии; пациентка скончалась на следующие сутки. Количественное определение концентраций цитокинов, хемокинов и факторов роста в кондиционированной среде и сыворотке крови, взятой у нашей пациентки, было выполнено с использованием мультиплексной технологии на платформе Luminex в соответствии с инструкциями производителя (Bio-Rad, США).
В дополнение для удаления избыточных концентраций цитокинов, поддерживающих шок, была проведена 1 сессия терапии с фильтром CytoSorb длительностью 24 часа. После этой сессии стало возможным удерживать среднее артериальное давление (САД) на уровне выше 65 мм рт.ст., значительно снизилась потребность в вазопрессорах, появилась возможность удалять избыточную жидкость с помощью ультрафильтрации. Изменения клинической картины свидетельствовали о прекращении сосудистых изменений, ранее способствовавших развитию и поддержанию шока (потеря давления и барьерных функций). К сожалению клинические и радиологические признаки тяжелого повреждения мозга заставили нас поменять терапевтическую стратегию и перейти симптоматической терапии; пациентка скончалась на следующие сутки. Количественное определение концентраций цитокинов, хемокинов и факторов роста в кондиционированной среде и сыворотке крови, взятой у нашей пациентки, было выполнено с использованием мультиплексной технологии на платформе Luminex в соответствии с инструкциями производителя (Bio-Rad, США).
Эффективность удаления цитокинов с помощью CytoSorb была подтверждена путем сравнения концентраций до начала терапии и 24 часа спустя (Таблица 2). 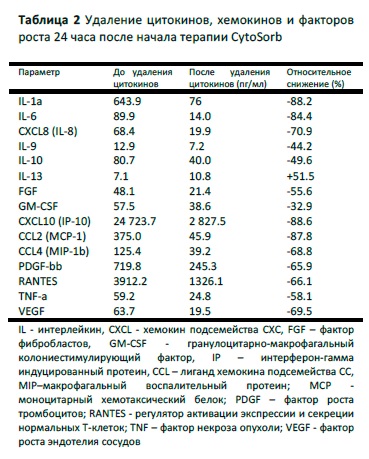 Повышение концентраций некоторыхцитокинов во время терапии, вероятно, результат скоростей биосинтеза, превосходящих скорость удаления. Стоит отметить, что концентрация антибиотиков до и после CytoSorb была на 76% ниже меропенема (с 25.5 до 6.4 мкг/мл) и на 58% для пиперациллина (11.7 до 4.9 мкг/мл).* Концентрация клиндамицина снизилась всего на 15% (с 14.0 до 11.9 мкг/мл). Ввиду этих наблюдений, мы настоятельно рекомендуем мониторинг концентрации лекарственных препаратов в крови пациентов с сепсисом при проведении экстракорпоральной детоксикации. Особенно заметным с клинической точки зрения было достижение гемодинамической стабильности во время удаления цитокинов. (Табл. 1). Для экспериментального анализа предполагаемого влияния адсорбции цитокинов на микрососудистое русло мы применяли ранее описанную in vitro систему [5]. Мы получили сыворотку крови пациентки непосредственно перед адсорбцией цитокинов и 24 часа спустя после ее начала. Клетки эндотелия были стимулированы полученными образцами в течение 30 минут, после чего морфологию эндотелиальных клеток исследовали путем флуоресцентной иммуноцитохимии на выявление VE-кадгерина (зеленый) и основных компонентов цитоскелета, например, F-актина (красный).
Повышение концентраций некоторыхцитокинов во время терапии, вероятно, результат скоростей биосинтеза, превосходящих скорость удаления. Стоит отметить, что концентрация антибиотиков до и после CytoSorb была на 76% ниже меропенема (с 25.5 до 6.4 мкг/мл) и на 58% для пиперациллина (11.7 до 4.9 мкг/мл).* Концентрация клиндамицина снизилась всего на 15% (с 14.0 до 11.9 мкг/мл). Ввиду этих наблюдений, мы настоятельно рекомендуем мониторинг концентрации лекарственных препаратов в крови пациентов с сепсисом при проведении экстракорпоральной детоксикации. Особенно заметным с клинической точки зрения было достижение гемодинамической стабильности во время удаления цитокинов. (Табл. 1). Для экспериментального анализа предполагаемого влияния адсорбции цитокинов на микрососудистое русло мы применяли ранее описанную in vitro систему [5]. Мы получили сыворотку крови пациентки непосредственно перед адсорбцией цитокинов и 24 часа спустя после ее начала. Клетки эндотелия были стимулированы полученными образцами в течение 30 минут, после чего морфологию эндотелиальных клеток исследовали путем флуоресцентной иммуноцитохимии на выявление VE-кадгерина (зеленый) и основных компонентов цитоскелета, например, F-актина (красный). 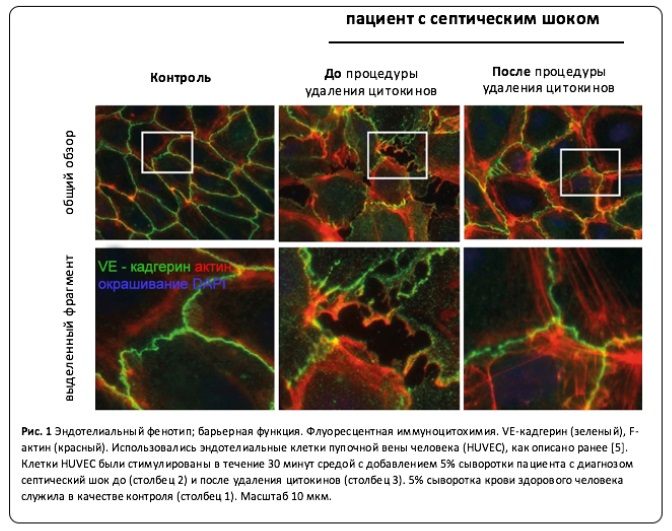 Стоит отметить, что сильный стресс, испытываемыйэндотелиальными клетками, ведет к полимеризации F-актина, которая, в свою очередь, дает толчок к формированию так называемых стрессовых волокон (стресс-фибрилл). Эти сжимающие силы цитоскелетной архитектуры вносят вклад в образование видимых промежутков между соседними клетками, что является проявлением клинического синдрома капиллярной утечки на клеточном уровне (Рис.1, средний столбец). Когда клетки эндотелия стимулировали сывороткой, взятой у пациентки после процедуры адсорбции цитокинов, было продуцировано меньше стресс-фибрилл, эндотелиальные клетки демонстрировали более защищенное от образования межклеточных пустот поведение (Рис.1, правый столбец). Затем были проведены измерения трансэндотелиального электрического сопротивления (TER) в реальном времени для объективной квантификации функциональной проницаемости стенок сосудов в результате образования этих межклеточных промежутков [6]. Аналогично эксперименту с окрашиванием, эндотелиальные клетки были инкубированы с плазмой пациентки, взятой до и после удаления цитокинов. Результаты измерения TER записывались в реальном времени каждую минуту в течение 120 минут с помощью системы определения импеданса клеточного субстрата (ECIS) с трехкратным резервированием. Эндотелиальные клетки, в которые ввели сыворотку, взятую у пациентки до проведения процедуры адсорбции цитокинов, продемонстрировали стремительное снижение среднего сопротивления (сообразное повышению проницаемости сосудов) (Рис. 2, жирная линия); при этом сыворотка плазмы крови той же пациентки, собранная после процедуры удаления цитокинов, имела явно сниженную остроту клеточного ответа в части проницаемости сосудов (Рис. 2, пунктирная линия).
Стоит отметить, что сильный стресс, испытываемыйэндотелиальными клетками, ведет к полимеризации F-актина, которая, в свою очередь, дает толчок к формированию так называемых стрессовых волокон (стресс-фибрилл). Эти сжимающие силы цитоскелетной архитектуры вносят вклад в образование видимых промежутков между соседними клетками, что является проявлением клинического синдрома капиллярной утечки на клеточном уровне (Рис.1, средний столбец). Когда клетки эндотелия стимулировали сывороткой, взятой у пациентки после процедуры адсорбции цитокинов, было продуцировано меньше стресс-фибрилл, эндотелиальные клетки демонстрировали более защищенное от образования межклеточных пустот поведение (Рис.1, правый столбец). Затем были проведены измерения трансэндотелиального электрического сопротивления (TER) в реальном времени для объективной квантификации функциональной проницаемости стенок сосудов в результате образования этих межклеточных промежутков [6]. Аналогично эксперименту с окрашиванием, эндотелиальные клетки были инкубированы с плазмой пациентки, взятой до и после удаления цитокинов. Результаты измерения TER записывались в реальном времени каждую минуту в течение 120 минут с помощью системы определения импеданса клеточного субстрата (ECIS) с трехкратным резервированием. Эндотелиальные клетки, в которые ввели сыворотку, взятую у пациентки до проведения процедуры адсорбции цитокинов, продемонстрировали стремительное снижение среднего сопротивления (сообразное повышению проницаемости сосудов) (Рис. 2, жирная линия); при этом сыворотка плазмы крови той же пациентки, собранная после процедуры удаления цитокинов, имела явно сниженную остроту клеточного ответа в части проницаемости сосудов (Рис. 2, пунктирная линия). 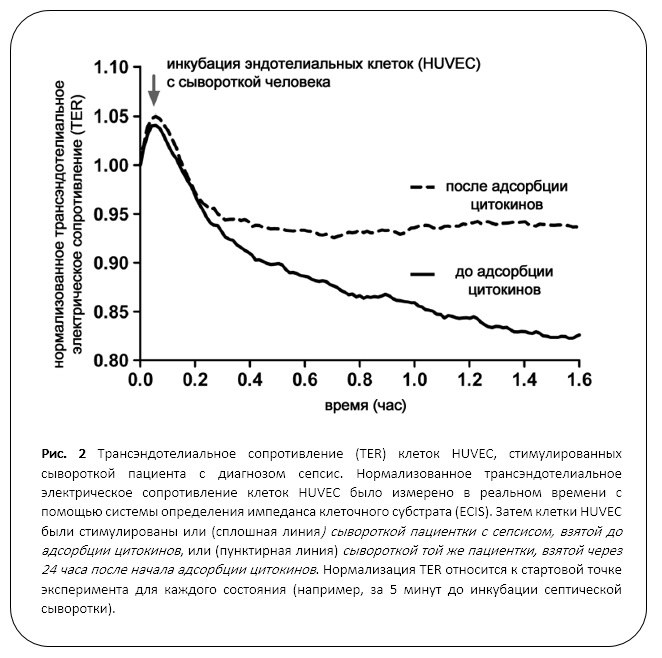
Обсуждение
В этой статье мы даем отчет о клиническом случае, описывающем терапию пациента с тяжелым сепсисом и ПОН с помощью ЭКМО и ЗПТ в режиме CVVHD. Дополнительное экстракорпоральное удаление цитокинов (в нашем случае применение CytoSorb) дало возможность стабилизировать состояние в течение всего нескольких часов. Наши результаты подтверждают гипотезу о наличии взаимосвязи между концентрацией цитокинов в плазме крови и изменением проницаемости сосудов: исследуя эндотелиальные клетки, мы обнаружили, что цитокины, активно циркулирующие при септическом шоке, в самом деле, могут негативно повилять на барьерные функции клеток. Один из возможных подходов к терапии может состоять в удалении цитокинов с помощью современных адсорбционных технологий, в частности для тех пациентов, которым и так требуется применение экстракорпорального контура, например для проведения ЗПТ или ЭКМО. Целесообразность такой комбинации адсорбции цитокинов с другими техниками, требующими экстракорпорального кровообращения, уже обсуждалась при рассмотрении другого случая терапии пациента с сепсисом [7]. Наше наблюдение, касающееся снижения концентрации антибиотика в плазме крови, имеет клиническое значение и подчеркивает важность тщательного контроля терапевтических концентраций лекарственных средств и адаптации дозировки во время проведения адсорбции Рис. 2 Трансэндотелиальное сопротивление (TER) клеток HUVEC, стимулированных сывороткой пациента с диагнозом сепсис. Нормализованное трансэндотелиальное электрическое сопротивление клеток HUVEC было измерено в реальном времени с помощью системы определения импеданса клеточного субстрата (ECIS). Затем клетки HUVEC были стимулированы или сывороткой пациентки с сепсисом, взятой до адсорбции цитокинов, или сывороткой той же пациентки, взятой через 24 часа после начала адсорбции цитокинов (пунктирная линия). Нормализация TER относится к стартовой точке цитокинов. То же касается других защитных факторов (мы наблюдали снижение концентрации противовоспалительного цитокина IL-10 у нашей пациентки (Таблица 2)). Взаимосвязь между иммунитетом и микрососудистым руслом в патогенезе ПОН вызывает особый интерес по двум причинам: (1) эндотелиальные клетки представляют собой контактную поверхность для циркулирующих цитокинов (потенциально вредоносных); (2) повышенная проницаемость капилляров с последующей утечкой внесосудистой жидкости в интерстиций все чаще признается отличительным признаком ПОН и маркером летального исхода при сепсисе [3, 4]. Однако в свете относительно низких абсолютных уровней концентрации цитокинов до процедуры адсорбции, нужно иметь ввиду, что благоприятное влияние, оказываемое на эндотелий, может быть вызвано нетаргетированным удалением других факторов, индуцирующих проницаемость капилляров.
Выводы
В соответствии с гипотезой о повышающем проницаемость капилляров взаимодействии цитокинов с эндотелием, мы наблюдали значительные изменения морфологии и функций эндотелиальных клеток при стимуляции их in vitro сывороткой пациентки с диагнозом септический шок. Эти клеточные изменения, клинически указывающие на нарушение сосудистого барьера, не фиксировались после проведения процедуры адсорбции цитокинов. Используя данные, полученные нами при работе с этой пациенткой, мы предполагаем, что экстракорпоральные методики адсорбции цитокинов (такие как CytoSorb) могут оказывать защитное влияние на целостность микрососудистого русла. Нет сомнений в том, что этот отчет о терапии одной пациентки является гипотезообразующим, и что требуется систематический анализ.
Благодарности
Мы благодарим Ивонн Николаи (Yvonne Nicolai) за превосходную техническую поддержку. Финансирование Саша Давид (Sasha David) получил грант на исследование от German Research Foundation (DA 1209/4-1).
Доступность данных и материалов
Данные, полученные и/или подвергнутые анализу во время настоящего исследования, предоставляются по запросу.
Научный вклад авторов
Саша Давид (Sasha David), Кристина Тамм (Kristina Thamm) и Ян Т.Кильштейн (Jan T. Kielstein) провели эксперименты in vitro и написали исходный текст. Бернадрд Шмидт (Bernard M.W.Schmidt) и Кристин С.Фальк (Christine S.Falk) провели множественный анализ и оказывали помощь в интерпретации данных. Саша Давид (Sasha David) и Ян Т.Кильштейн (Jan T. Kielstein) проводили терапию. Все авторы прочли и одобрили настоящий текст.
Конфликт интересов
Авторы заявляют, что конфликт интересов отсутствует
Согласие на публикацию
Согласие на публикацию было подписано родственниками пациента
Одобрение этического комитета
Получено от местного этического комитета Hannover Medical School (2786-2015). Родственники пациента дали согласие на проведение исследования.
Об авторах
1 Медицинский факультет, отделение нефрологии и гипертензии, Hannover Medical School, Carl- Neuberg-Str. 1, 30625 Hannover, Germany.
2 Институт трансплантационной иммунологии IFB-Tx, Hannover Medical School, Carl-Neuberg-Str. 1, 30625 Hannover, Germany.
* авторам был задан вопрос о времени проведения измерений концентраций лек. средств: концентрации измерялись, в отличие от ожидаемого, не после окончания терапии CytoSorb, а ПОСЛЕ ОКОНЧАНИЯ ВСЕХ ТЕРАПЕВТИЧЕСКИХ ДЕЙСТВИЙ.
Получено 7 октября 2016 года Принято: 11 января 2017
Опубликовано онлайн 21 января 2017
Ссылки:
1. Singer M, Deutschman CS, Seymour CW, Shankar-Hari M, Annane D, Bauer M, Bellomo R, Bernard GR, Chiche JD, Coopersmith CM, et al. The third international consensus definitions for sepsis and septic shock (sepsis-3). JAMA. 2016;315(8):801–10.
2. Hotchkiss RS, Karl IE. The pathophysiology and treatment of sepsis. N Engl J Med. 2003;348(2):138–50.
3. Aird WC. The role of the endothelium in severe sepsis and multiple organ dysfunction syndrome. Blood. 2003;101(10):3765–77.
4. Lee WL, Slutsky AS. Sepsis and endothelial permeability. N Engl J Med. 2010; 363(7):689–91.
5. David S, Mukherjee A, Ghosh CC, Yano M, Khankin EV, Wenger JB, Karumanchi SA, Shapiro NI, Parikh SM. Angiopoietin-2 may contribute to multiple organ dysfunction and death in sepsis*. Crit Care Med. 2012;40(11): 3034–41.
6. David S, Ghosh CC, Mukherjee A, Parikh SM. Angiopoietin-1 requires IQ domain GTPase-activating protein 1 to activate Rac1 and promote endothelial barrier defense. Arterioscler Thromb Vasc Biol. 2011;31(11):2643–52.
7. Bruenger F, Kizner L, Weile J, Morshuis M, Gummert JF. First successful combination of ECMO with cytokine removal therapy in cardiogenic septic shock: a case report. Int J Artif Organs. 2015;38(2):113–6.