Ключевые слова: методы анестезии, регионарная; техники и методики измерений, ультразвук; нерв, блокада
Возможность обеспечить оптимальное распределение местного анестетика при проведении регионарных анестезиологических блокад является ключевым моментом для достижения успеха. Этой цели легче всего достичь, используя ультразвуковую визуализацию. Исследовательская группа из Вены в прошедшие десять лет доказала, что ультразвуковой контроль дает возможность значительно повысить качество нервных блокад при всех типах регионарной анестезии. Также данный метод позволяет избежать таких осложнений, как случайные введения анестетика внутрь сосуда или нерва. Перечень потенциальных преимуществ регионарных анестезиологических методик, проводимых под контролем ультразвука, приведен в Таблице 1.
Таблица 1 Потенциальные преимущества ультразвукового контроля по сравнению с традиционными методиками идентификации нерва в регионарной анестезии
| Потенциальное преимущество | Ссылки на список литературы |
| Прямая визуализация нервов | 13, 17, 21, 26, 27, 37, 39, 40, 52, 54, 62, 66 |
| Прямая визуализация анатомических структур (кровеносных сосудов, мышц, костей, сухожилий), облегчающая идентификацию нервов | 23, 26, 27, 31, 32, 33, 37, 38, 39, 40, 52, 54, 57, 62, 66 |
| Прямая и непрямая визуализация распределения местного анестетика во время введения с возможностью переместить иглу в случае неправильного распределения анестетика | 26, 27, 37, 38, 39, 40, 54 |
| Возможность избежать побочных эффектов (например, введения анестетика в нерв, случайного внутрисосудистого введения анестетика) | 20, 21, 26, 27, 37, 38, 39, 40, 54 |
| Возможность избежать болезненных мышечных сокращений при нейростимуляции (например, при переломах) | 40 |
| Снижение дозы местного анестетика | 38, 39 |
| Быстрая потеря чувствительности | 37, 39, 40, 54 |
| Повышение длительности блокад | 40 |
| Повышение качества блокады | 37, 39, 40, 54 |
Использование ультразвукового контроля в ежедневной клинической практике требует наличия высококачественного ультразвукового оборудования и высокого уровня подготовки специалистов. Анестезиологам необходимо развивать глубокое понимание задействованных в блокаде анатомических структур, а также иметь как основательные знания в области ультразвуковых технологий, так и практические навыки по визуализации нервных структур. Успех нервной блокады под контролем ультразвука варьируется в зависимости от навыков оператора в использовании конкретной методики регионарной анестезии. Опыт, накопленный нашей группой, показывает, что наиболее правильным было бы начинать осваивать применение ультразвукового контроля при осуществлении блокады с периферических нервов и под контролем опытных специалистов, и только после этого переходить к блокадам центральных нервов. Несмотря на отсутствие специфических кривых обучения по проведению нервных блокад под ультразвуковым контролем, мы наблюдали быстрый рост числа успешных блокад, выполненных опытными в регионарной анестезии врачами-анестезиологами, и всегда зависевшими от индивидуальных способностей врача. Для того, чтобы приобрести более опыт и базовые навыки в области ультрасонографии и регионарной анестезии, заинтересованным анестезиологам необходимо принимать участие в специальных мастер-классах.
Наша группа произвела свыше 4000 нервных блокад под прямым ультразвуковым контролем с тех пор, как эта методика была впервые применена на практике 10 лет назад. Степень успешности составила почти 100%. В дополнение к высокой степени успешности в сравнении с традиционными методами контроля нейростимуляции, были отмечены серьезные улучшения в области времени до начала сенсорных и моторных реакций. Повышение качества периоперационного обезболивания существенно увеличило степень удовлетворенности как взрослых пациентов, так и детей.
В этой обзорной статье мы обсуждаем позиции ультразвукового контроля при регионарной анестезии в настоящее время, используя оба наших исследования, а также недавние публикации других авторов на эту тему. В нашей статье мы описываем техническую базу, рекомендуем подходящее оборудование, а также приводим перечень типов нервных блокад, при которых возможно осуществление ультразвукового контроля, а также алгоритм их выполнения наиболее простым и безопасным способом.
Актуальность темы
Нервы блокирует местный анестетик, а не игла. Традиционные методики контроля, применяемые в регионарной анестезии, не соответствуют этому абсолютно логическому требованию. «Слепые» блокады, опирающиеся исключительно на анатомические маркеры и/ или фасциальные щелчки (например, блокада подвздошно-пахового нерва), как известно, чреваты серьезными осложнениями [24, 53]. Даже нейростимуляция, рекомендованная к использованию в качестве золотого стандарта идентификации нерва в регионарной анестезии, в последнее десятилетие не позволяет обеспечить надлежащий уровень блокады нерва (например, при выполнении блокады подмышечно-плечевого нервного сплетения). Также существует опасность повредить нервные структуры вследствие прямого прокола [14].
До появления ультразвука в сфере регионарной анестезии было невозможно точно определить местонахождение кончика иглы по отношению к нервам и проконтролировать распределение местного анестетика. Ультразвуковая визуализация анатомических структур – единственный метод, позволяющий проводить безопасные блокады высокого качества благодаря точному позиционированию иглы. Дополнительным преимуществом ультразвукового контроля можно назвать сокращение объема местного анестетика, необходимого для эффективной нервной блокады, за счет мониторинга его распределения [39].
Впервые об использовании ультразвука при проведении нервных блокад сообщил в 1978 году La Grange и соавторы, осуществившие надключичный блок плечевого сплетения при помощи допплеровского детектора кровотока [35]. Эти ранние доклады не оказали существенного клинического воздействия, поскольку возможности визуализации анатомических структур были все еще ограниченными. Вся визуализация сводилась к идентификации сосудов посредством допплеровского ультразвукового аппарата. Однако в последние десять лет произошел значительный прогресс. Последние ультразвуковые изображения [40, 50], полученные в регионарной анестезии, сильно отличаются от снимков, выполненных несколько лет назад [8, 39, 66].
В двух последних редакционных статьях Greher и соавторы [21] и Петерсон [51] рассматривали различные важные аспекты использования ультразвука для идентификации нервных структур в регионарной анестезии. Оба соглашаются в том, что ультразвук будет методикой контроля в будущем, но окончательный переход от традиционной методики нейростимуляции к ультразвуку займет еще 10 лет или больше. Необходимо преодолеть серьезные интеллектуальные препятствия, и перераспределение финансовых ресурсов также не может произойти быстрее. Однако если наши пациенты имеют право на получение качественного анестезиологического сопровождения, превалировать должны наиболее оптимальные методики выполнения блокады нервов.
Оборудование
Визуализация нервов посредством звуковых волн требует использования высокочастотного оборудования, обеспечивающего снимки высокого разрешения. Однако чем выше частота, тем меньше глубина проникновения. Для проведения большинства блокад нервов требуется оборудование с частотой в диапазоне 10-14 МГц. Широкополосные трансдюсеры, покрывающие полосу частот от 5 до 12 или от 8 до 14 МГц, обеспечивают отличное разрешение поверхностных структур в высокочастотном диапазоне и хорошую глубину проникновения в низкочастотном диапазоне.
Соединительная ткань внутри нервов (периневрий и эпиневрий) отражает ультразвуковые волны анизотропным образом. По большому счету, угол и интенсивность отражения зависит от угла ультразвуковой волны по отношению к продольной оси нерва. Абсолютная эхогенность нерва достижима только, если звуковой пучок ориентирован перпендикулярно оси нерва. Следовательно, линейные датчики с параллельным выбросом ультразвукового пучка имеет преимущество перед секторным датчиком, которые характеризуются распределением звукового пучка таким образом, что эхоструктура нерва будет отображаться только в центре изображения.
Блокаду нерва под контролем ультразвука можно осуществить с помощью наиболее современных ультразвуковых систем. Они должны отображать как поверхностные ткани, так и костно-мышечные структуры. Ультразвуковые системы высокого разрешения (HRUS) снабжены программным обеспечением, позволяющим качественно выполнять визуализацию контрастных тканей. Также система должна иметь режимы цветового доплеровского картирования и импульсный допплер для идентификации сосудов. Аппарат должен быть снабжен жестким диском большой вместимости для хранения изображений и последовательных короткометражных фильмов, а также устройством для записи CD для сохранения файлов с данными сразу в форматах TIF, JPG, BMP и MPG4.
В последние годы на рынке появились портативные ультразвуковые модули, отвечающие описанным выше характеристикам. Стоимость таких модулей существенно ниже, чем больших ультразвуковых систем.
Сонографический вид периферических нервов
Периферические нервы могут иметь гипоэхогенный (темные структуры) или гиперэхогенный (светлые структуры) сонографический вид, [13, 57], что зависит от размера нерва, сонографической частоты и угла ультразвукового пучка. Мы выполняем большинство блокад с использованием поперечного сканирования, при котором нервы выглядят, как многочисленные круглые и овальные гипоэхогенные плоскости, окруженные относительно гиперэхогенной зоной (Рис.1).
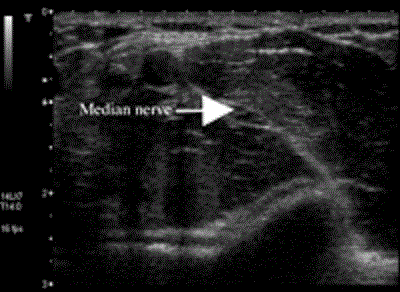
Рисунок 1 Поперечный срез срединного нерва на уровне локтя, выполненный при помощи системы Aplio линейным датчиком с частотой 8-14 МГц (Toshiba Medical Systems, Tustin, CA).
Эти гиперэхогенные структуры представляют собой пучки нервов, а гипоэхогенный фон отражает соединительную ткань между нейронными структурами. В продольном виде каждый нерв предстает в виде относительно гиперэхогенной зоны, характеризующейся наличием многочисленных гипоэхогенных полос, чередующихся с гиперэхогенными линиями (Рис.2).
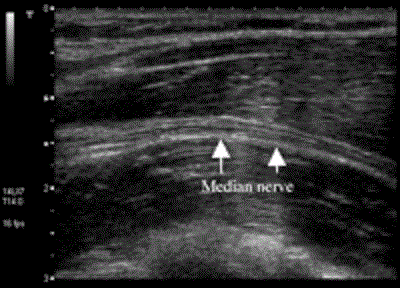
Рисунок 2 Продольный срез срединного нерва ниже уровня локтя, выполненный при помощи системы Aplio линейным датчиком с частотой 8-14 МГц (Toshiba Medical Systems, Tustin, CA).
Поскольку пучки нервов представляют собой основной сонографический элемент периферических нервов, их вид можно описать как «пучковидную структуру» в противоположность «волокнистой структуре» сухожилий, характеризующейся многочисленными сплошными гипоэхогенными линиями. Количество пучков нервов, которые отображает ультразвуковая система высокого разрешения, не соответствует реальному числу пучков в нерве, поскольку маленькие пучки не отображаются ультразвуком. «Пучковую структуру» можно считать довольно типичной для больших периферических нервов (например, срединного, локтевого и лучевого нервов) и не наблюдается у более мелких нервов (например, у возвратного гортанного и вагусного нервов).
Большую часть периферических нервов возможно отобразить на всем их протяжении. Их визуальная доступность ограничивается только при наличии дорсальных теней от костных структур или больших сосудов.
Выполнение блокады нерва под контролем ультразвука
Первым шагом в осуществлении блокады нерва под контролем ультразвука является визуализация всех анатомических структур в целевой области. Следует настроить все регулируемые ультразвуковые показатели, такие, как глубина проникновения, частоты и расположение фокусных зон, в соответствии с типом выполняемой блокады. Необходимо продезинфицировать кожу и ультразвуковой датчик. Большинство традиционных средств дезинфекции можно использовать для стерилизации ультразвуковых датчиков. Стерильный ультразвуковой гель обеспечит асептические условия для проведения блокады нерва (также можно использовать гель для постановки мочевого катетера). В качестве альтернативного варианта на датчик можно надеть стерильную перчатку.
Следующим шагом будет выполнить подкожную инфильтрацию с целью обезболивания. Мы используем иглы 22 калибра (22g) длиной 40-80 мм с фасетным срезом (Pajunk™, г. Гайзинген (Geisingen), Германия). В зависимости от типа блокады, прокол следует выполнять в 5-10 мм дистальнее или проксимальнее датчика с визуализацией в поперечном плане. Рисунок 3 показывает, что идентификация иглы возможна только, когда игла пересекает ультрасонографический уровень датчика.
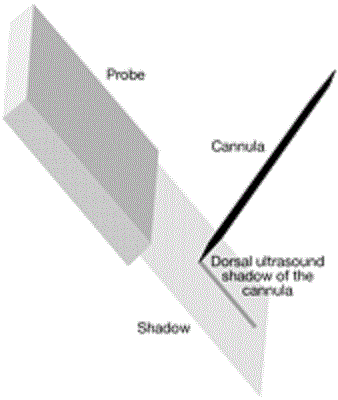
Рисунок 3 Сонографическая визуализация канюли. Линейный датчик выполняет снимок в прямоугольно-поперечном сечении в зависимости от характеристик датчика, вследствие частотно-зависимой глубины проникновения (чем выше ультразвуковая частота, тем меньше глубина проникновения). Канюля может быть приведена к любой точки сечения и определяется как гипоэхогенная структура с дорсальной акустической тенью.
Сама игла определяется в виде гипоэхогенной структуры и образует дорсальную акустическую тень. Также иглу можно определить по непосредственному движению иглы и изменению расположения ткани. Важно наполнить иглу местным анестетиком до прокола, чтобы не допустить образования пузырей воздуха. Когда игла установлена в нужном месте, анестетик вводится с одновременной визуализацией его распределения до тех пор, пока нервные структуры не будут окружены местным анестетиком. Если анестетик распределяется в неверном направлении, иглу нужно переместить таким образом, чтобы правильно распределить анестетик.
Perlas и соавторы [50] предложили методику, при которой иглу вводят в продольном относительно ультразвукового датчика (длинной оси) направлении. Однако этот путь ввода в 3 раза длиннее, чем поперечное направление (короткая ось). При поперечном подходе направление иглы совпадает с ее направлением при нейростимуляции. Мы предпочитаем эту методику ввода иглы в большинстве блокад, поскольку более короткое введение комфортнее для пациента.
Возможность наблюдать процесс распределения местного анестетика посредством ультрасонографии позволяет минимизировать необходимую для успешного выполнения блокады дозу вводимого анестетика, что особенно важно при проведении нескольких блокад (например, блокады 3-в-1 или блокаде седалищного нерва). Больше всего от этого преимущества [38] выигрывают пожилые и ослабленные пациенты.
Блокады нервов верхних конечностей
Плечевое нервное сплетение формируется из передних ветвей спинномозговых нервов сегметов C5–T1. У 60% и 30% пациентов соответственно сплетение также включает корешки сегментов С4 и Т2. Корешки проходят позади позвоночной артерии через межпозвоночное отверстие. Оттуда они входят прямо в пространство за лестничной мышцей, спускаются до первого ребра и сливаются в три ствола сплетения (верхний, средний и нижний), которые затем разветвляются и образуют переднюю и заднюю ветви на надключичном уровне. После пересечения первого ребра они разделяются на заднюю, боковую и медиальную ветви, формируя терминальные нервы, которые начинаются от верхней границы ключицы. Часть нервов спускается с более близкой позиции на уровне стволов (например, от надлопаточного нерва). В «зоне девиации» на уровне первого ребра стволы нервов, входящих в плечевое сплетение, закручиваются вокруг подключичной артерии наподобие штопора. Таким образом, боковой и задний стволы оказываются в вентральной и средней позициях соответственно, как раз под ключицей. На этом уровне средний ствол располагается под боковым. Другими словами, обозначения данных стволов применимы к ним только на подмышечном уровне.
Межлестничный блок плечевого нервного сплетения
Этот тип блокады показан при хирургических вмешательствах в области плеча и верхней части руки. Первоначально Winnie производил прокол иглой на уровне ларингеального выступа на латеральном крае грудинноключичнососцевидной мышцы в перпендикулярном направлении [63]. Упомянутое направление ввода иглы приводило к серьезным осложнениям, таким как прокол эпидурального пространства [36, 59] или случайный ввод местного анестетика в позвоночную артерию (с риском судорог) [58]. Метод позже модифицировал Meier и соавторы, применявшие более краниальный прокол и направлявшие иглу по касательной [41]. Степень успеха варьируется от 50% [11] до 94%.
Плечевое сплетение можно без труда отобразить с помощью ультразвука на уровне заднего межлестничного пространства (Рис.4). Прощупывание начинают латеральнее гортани с визуализации щитовидной железы, сонной артерии и яремной внутренней вены. Между двумя этими сосудами можно обнаружить блуждающий нерв. Поскольку датчик передвигается сбоку от латерального края грудинноключичнососцевидной мышцы с небольшим каудальным колебанием наконечника датчика, нервы отображаются в поперечном виде как многочисленные круглые или овальные гипоэхогенные области, расположенные между передней и средней лестничными мышцами.
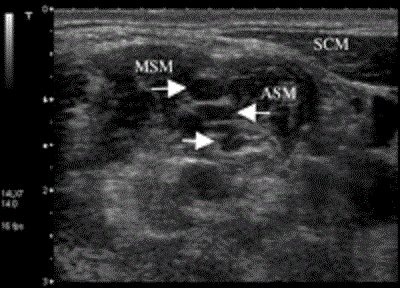
Рисунок 4 Поперечный вид плечевого сплетения на латеральной границе грудинноключичнососцевидной мышцы на уровне заднего межлестничного пространства между передней и средней лестничными мышцами. Снимок выполнен с использованием системы Aplio линейным датчиком с частотой 8-14 МГц (Toshiba Medical Systems, Tustin, CA). Стрелками указаны корешки плечевого нервного сплетения, которое отображается в виде гипоэхогенных овальных структур. ASM=anterior scalene muscle (передняя лестничная мышца); MSM=median scalene muscle (средняя лестничная мышца); SCM=sternosternocleidomastoid muscle (грудинноключичнососцевидная мышца).
После прокола кожи в 1 см от датчика со стороны черепа в межлестничное пространство вводится игла 22 калибра (22g) длиной 4 см с фасетным срезом для инъекции местного анестетика под прямой ультразвуковой визуализацией (Рис.5).
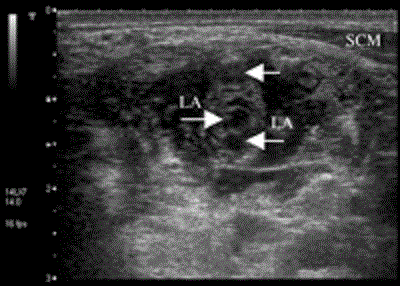
Рисунок 5 Вид межлестничного пространства после введения 15 мл местного анестетика. Снимок выполнен с использованием системы Aplio линейным датчиком с частотой 8-14 МГц (Toshiba Medical Systems, Tustin, CA). Стрелками указаны нервные корешки плечевого нервного сплетения, окруженные местным анестетиком. LA=local anaesthetic (местный анестетик); SCM=sternosternocleidomastoid muscle (грудинноключичнососцевидная мышца).
Дозы в 10-15 мл обычно достаточно для обеспечения полной блокады плечевого нервного сплетения. Полную блокаду плечевого нервного сплетения с этой позиции можно осуществить посредством небольшого перемещения иглы для охвата корешка Т1, который представляет собой часть локтевого нерва и не блокируется в результате нейростимуляции. В случае, когда необходимо длительное обезболивание плечевого нервного сплетения, в межлестничное пространство может быть введен катетер.
Надключичный блок плечевого нервного сплетения
Группа из Вены разработала методику надключичного доступа под контролем ультразвука и сопоставила ее с подмышечным доступом, показав, что высокая степень успеха достижима даже с использованием ультразвукового аппарата, который являлся новейшей системой в 1994 году [26]. Совсем недавно Williams и соавторы [62] сравнили ту же методику с нейростимуляцией и пришли к выводу, что ультразвуковой контроль превосходит последний, что подтверждают другие исследования блокад верхних и нижних конечностей. Они пришли к выводу, что в то время, как неопытные пользователи применяют одновременно нейростимуляцию и ультразвук для уточнения положения иглы, предпочтительнее избегать стимуляции нерва, таким образом избавляя пациента от болезненных сокращений мышц, сопровождающих этот метод.
Полностью отобразить плечевое нервное сплетение около подключичной артерии можно, передвинув ультразвуковой датчик из «межлестничной» позиции, описанной выше, в надключичную позицию (Рис.6).
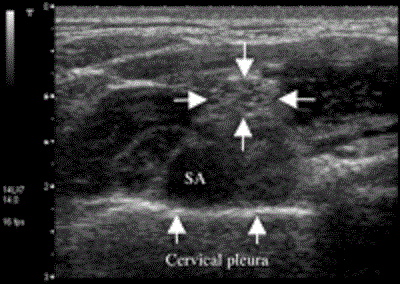
Рисунок 6 Поперечный вид надключичного плечевого сплетения краниолатеральнее подключичной артерии. Стрелками указано плечевое сплетение. Расстояние от поверхности кожи до плевры равно 2,2 см. SA=subclavian artery (поключичная артерия).
Поскольку интересующие структуры расположены близко к поверхности кожи, для визуализации в хорошем разрешении может быть использован высокочастотный линейный датчик (12 МГц или, что предпочтительнее, 14 МГц). В то время как трудно идентифицировать каждый из трех стволов, а также отличить переднюю ветвь от задней вследствие их близкого расположения, отдельные части плечевого сплетения адекватно обозначаются для практических целей пока датчик медленно передвигается в краниокаудальном направлении. Место прокола располагается краниальнее ультразвукового датчика. Местный анестетик следует вводить до тех пор, пока он не окружит стволы нервов (обычно 10-15 мл).
Рисунок 6 иллюстрирует близость плечевого нервного сплетения к куполу плевры. Таким образом не следует считать надключичный подход рутинной процедурой, вне зависимости от степени сопровождения ее ультразвуковым контролем. Скорее ее можно считать оправданной, только если невозможно выполнение блокады через подключичный подход, например, если в большую грудную мышцу имплантирован кардиостимулятор.
Нижнеключичный блок плечевого нервного сплетения
Вертикальный нижнеключичный (VIP (vertical infraclavicular brachial plexus block) блок плечевого нервного сплетения был одним из наиболее популярных подходов к плечевому сплетению с тех пор, как его описал Kilka и соавторы в 1995 году [30]. Степень успеха варьируется от 88% [45] до 95% [21]. Говорилось, что при этом доступе можно легко идентифицировать анатомические ориентиры, но были описаны также и серьезные осложнения [46]. Место прокола располагается посередине между яремной вырезкой и вентральной стороной акромиона.
Исследуя с помощью ультразвука надежность «VIP-точки» Greher и соавторы предложили совершенно новую позицию [21]. Результаты их изысканий указывали, что «VIP-точка» и нижнеключичное место прокола совпало менее, чем у 20% пациентов. Согласно Greher и соавторам, понятие «VIP-точки» верно только, когда расстояние между яремной вырезкой и акромионом составляет 22 см. При уменьшении или увеличении этого расстояния на 1 см, место прокола должно быть смещено на 2 мм латеральнее или ближе к середине соответственно. Neuburger и соавторы [47] подтвердили эти наблюдения в клиническом исследовании и соответственно скорректировали «VIP-точки».
На основании результатов, полученных Greher и его коллегами [21], можно утверждать, что все нижнеключичные блокады плечевого нервного сплетения следует выполнять под ультразвуковым контролем. Расстояние между плечевым сплетением и плеврой можно увеличить, выбрав более латеральный доступ, чтобы избежать случайного прокола купола плевры.
В 1999 году Kapral и соавторы презентовали свой вариант латерального нижнеключичного доступа к плечевому сплетению, такой же безопасный в плане осложнений, как и подмышечный доступ, и позволяющий блокировать дополнительно целый ряд нервов (мышечно-кожный, грудоспинной, подмышечный нервы и медиальный кожный нерв плеча) [29]. Эти находки подтвердились и у детей [17]. Рисунок 7 иллюстрирует плечевое сплетение латеральнее сосудов вокруг места прокола для VIP блокады; Рисунок 8 получен позже латеральнее, возле клювовидного отростка лопатки. Оба рисунка демонстрируют большее расстояние плечевого сплетения от плевры в приблизительной VIP-точке благодаря намеренно латеральной позиции ультразвукового датчика.
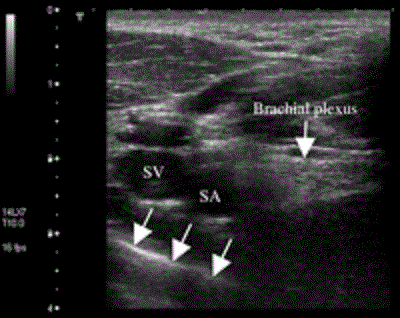
Рисунок 7 Поперечный вид подключичной части плечевого сплетения на среднем подключичном уровне. Снимок выполнен с использованием системы Aplio линейным датчиком с частотой 8-14 МГц (Toshiba Medical Systems, Tustin, CA). Стрелками в нижнем левом углу обозначена плевра. SA=subclavian artery (подключичная артерия); SV=subclavian vein (подключичная вена).
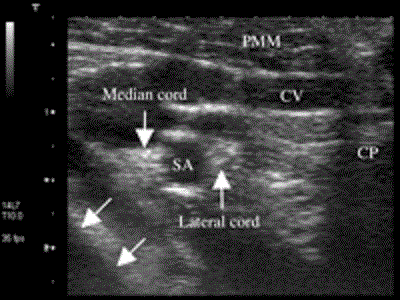
Рисунок 8 Поперечный вид подключичной части плечевого сплетения возле клювовидного отростка. Снимок выполнен с использованием системы Aplio линейным датчиком с частотой 8-14 МГц (Toshiba Medical Systems, Tustin, CA). Латеральнее и медиальнее подключичной артерии визуализируются латеральный и срединный стволы. Задний ствол при таком разрезе не визуализируется. Стрелками в нижнем левом углу обозначена плевра. CP=coracoid process (клювовидный отросток); CV=cephalic vein (подкожная латеральная вена руки); PMM=pectoris major muscle (большая грудная мышца); SA=subclavian artery подключичная артерия).
Sandhu и Capal сообщили о 90% успешных обезболиваний в хирургии при выполнении нижнеключичного блока плечевого сплетения под ультразвуковым контролем с использованием датчика с частотой 2,5 МГц [54]. Идея идентифицировать нервные структуры на низких частотах находится в резком противоречии с нашим собственным опытом. Мы используем для нижнеключичных нервных блокад линейные датчики с частотой 5-12 МГц. Ультразвуковые снимки при таком доступе всегда будут уступать по качеству снимкам при других вариантах доступа, поскольку высокие частоты поглощаются мышцами. Однако таких снимков достаточно, чтобы идентифицировать плечевое сплетение у большинства пациентов. Прокол выполняется ниже или выше датчика иглой 22 калибра (22g) длиной 8 см с фасетным срезом. Для детей мы используем иглу длиной 4 см.
В недавнем исследовании венской группы описана 100% степень успеха при использовании ультразвукового контроля для латеральной нижнеключичной блокады плечевого нервного сплетения у детей, причем результатом блокады стало как хирургическое обезболивание, так и целый ряд блокированных нервов [40]. Также использование ультразвукового контроля позволяет полностью исключить острую боль от сокращения мышц в результате пункции плечевого сплетения при нейростимуляции.
Подмышечный блок плечевого нервного сплетения
Эта методика продолжает оставаться наиболее популярным доступом к плечевому сплетению. Хотя осложнения встречаются редко, один автор сообщал о трех случаях тяжелых неврологических травм [56]. Заявленная степень успеха в 70-80% [3, 45] трудно достижима. Такие низкие показатель успешности могут быть следствием неудачной блокады лучевого нерва при проколе выше подмышечной артерии [42]. Несмотря на популярность подмышечного доступа, остается еще много нерешенных вопросов.
Retzl и соавторы описали использование высокочастотной ультрасонографии для идентификации нервов на подмышечном уровне [52]. Они отметили, что положение основных нервов плечевого сплетения не было постоянным относительно подмышечной артерии, но существенно изменялось даже в результате мягкого надавливания (например, при пальпации подмышечной артерии). Это наблюдение может помочь объяснить высокий уровень неудач при проведении подмышечных блокад плечевого сплетения.
Ультразвуковой контроль при проведении подмышечной блокады плечевого сплетения должен выполняться с помощью высокочастотного датчика (с частотой 12 МГц и выше). Срединный нерв может быть легко визуализирован, поскольку он расположен за подмышечной артерией, вдоль нее вплоть до локтевого уровня. Локтевой нерв расположен ближе к центру по отношению к артерии и находится ближе к поверхности кожи, чем срединный нерв на всем протяжении вниз вплоть до предплечия. Лучевой нерв, расположенный под артерией, может вызывать трудности при визуализации [42]. Несмотря на то, что лучевой нерв бывает трудно увидеть из-за акустической тени, отбрасываемой артерией, анестезиолог может переместить датчик немного дорсальнее и визуализировать нерв на уровне плечевой кости, в том месте, где радиальный нерв выходит из-под артерии и входит в борозду лучевого нерва.
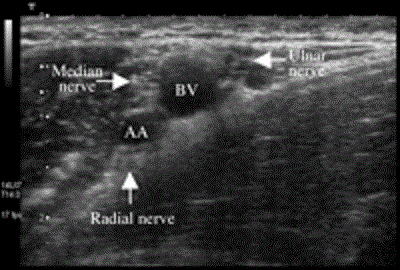
Рисунок 9 Поперечный вид подмышечной части плечевого сплетения. Снимок выполнен с использованием системы Aplio линейным датчиком с частотой 8-14 МГц (Toshiba Medical Systems, Tustin, CA). AA=axillary artery (подмышечная артерия); BV=basilic vein (подкожная медиальная вена руки).
На Рисунке 9 показаны все три нерва в поперечном сечении. Плечевой и предплечный кожные нервы из медиального пучка могут также визуализироваться с помощью датчика с частотой 14 МГц (не изображено). Игла 22 калибра (22g) длиной 4 см вводится с указанной позиции на 1-2 см ниже артерии (справа на Рис. 9), и выполняется блокада каждого из трех нервов с использованием 5-8 мл местного анестетика. Детальное описание этой методики многоточечного ввода анестетика, которая не изменилась со временем, если не считать замены нейростимуляции на ультразвуковой контроль, можно найти у Koscielnak-Nielsen и соавторов [34] и у Fanelli и соавторов [10]. Также, хотя это и отрицается в литературе, ультразвуковая визуализация позволяет даже выявлять септальные структуры между нервами у 10% пациентов.
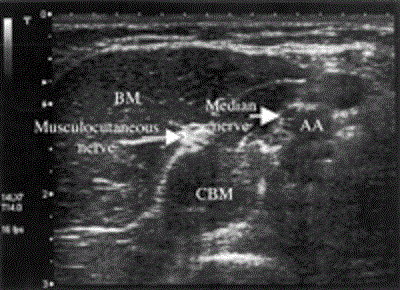
Рисунок 10 Поперечный вид мышечно-кожного нерва между двуглавой и клювовидно-плечевой мышцами. Снимок выполнен с использованием системы Aplio линейным датчиком с частотой 8-14 МГц (Toshiba Medical Systems, Tustin, CA). AA=axillary artery (подмышечная артерия); BM=biceps muscle (двуглавая мышца); CBM=coracobrachial muscle (клювовидно-плечевая мышца).
Мышечно-кожный нерв берет начало в латеральном пучке. Будучи расположенным между клювовидно-плечевой и пекторальными мышцами (Рис.10), он обычно отделен от других нервов на уровне подмыПоперечный вид мышечно-кожного нерва между двуглавой и клювовидно-плечевой мышцами. Снимок выполнен с использованием системы Aplio линейным датчиком с частотой 8-14 МГц (Toshiba Medical Systems, Tustin, CA). AA=axillary artery (подмышечная артерия); BM=biceps muscle (двуглавая мышца); CBM=coracobrachial muscle (клювовидно-плечевая мышца).шечной впадины, вследствие чего не может быть блокирован инъекцией местного анестетика через подмышечный доступ. У большинства пациентов мышечно-кожный нерв можно легко увидеть с помощью ультразвука и эффективно блокировать инъекцией 3 мл местного анестетика, слегка передвинув иглу в краниальном направлении.
Блокады периферических нервов верхних конечностей
Ультразвуковой контроль также очень полезен при блокадах периферических нервов верхних конечностей, поскольку он позволяет анестезиологу сократить дозу используемого местного анестетика и провести иглу к нерву быстро и безопасно. Более того, прямая визуализация нервов способствует использованию нескольких мест прокола при обезболивании верхних конечностей. Также можно проследить всю анатомическую структуру нерва от подмышечной впадины о запястья. На Рисунке 11 показан срединный нерв на локтевом уровне рядом с плечевой артерией. Для идентификации нервов больше не нужны анатомические ориентиры, с этой задачей полностью справляется ультрасонография.

Рисунок 11 Поперечный вид срединного нерва (обозначен стрелками) рядом с плечевой артерией. Снимок выполнен в режиме цветного Допплера с помощью системы Aplio линейным датчиком с частотой 8-14 МГц (Toshiba Medical Systems, Tustin, CA). BA=brachial artery (плечевая артерия).
Блокады нервов нижних конечностей
Пояснично-крестцовое сплетение (T12/L1–S3/4) обеспечивает сенсорную, моторную и симпатическую иннервацию нижних конечностей. Поясничное сплетение состоит из передних сегментов корешков верхних четырех поясничных нервов и опускается, проходя перед поясничной мышцей, к поперечным отросткам поясничных позвонков. Крестцовое сплетение, состоящее из передних сегментов корешков L4/5–S3/4, опускается через большое седалищное и подгрушевидное отверстия. Хотя блокады периферических нервов могут заменить собой нейроаксиальные методики, для их выполнения требуется сделать два прокола. Вследствие этого, было бы полезно сократить объем вводимого местного анестетика, особенно у пожилых пациентов и пациентов, страдающих сердечно-сосудистыми заболеваниями [38].
Блокада три-в-одном
Тридцать лет назад Winnie и соавторам [64] удалось выполнить блок бедренного, запирательного нервов и латерального кожного нерва бедра с помощью одной паховой околососудистой инъекции. Этот доступ стал называться блоком «3-в-1». Так же, как и у блоков нервов верхних конечностей под контролем нейростимуляции, степень неудач у блока «три-в-одном» доходит до 20% [48, 60]. Для ультразвукового контроля при проведении блокады «три в одном» идеально подойдет высокочастотный линейный датчик с частотой 10 МГц и выше, что связано с относительно поверхностным расположением бедренного нерва, удаленным от паховой связки и находящимся латеральнее бедренной артерии, под подвздошно-гребешковой фасцией (Рис.12). Прокол выполняется на 1 см дистальнее датчика иглой 22 калибра (22g) длиной 4 см с последующим введением 20 мл местного анестетика. Ультразвуковой контроль позволяет анестезиологу переместить иглу в случае неправильного распределения над подвздошно-гребешковой фасцией.
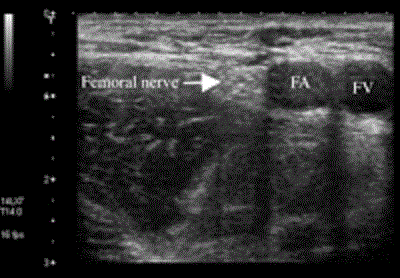
Рисунок 12 Поперечный вид бедренного нерва латеральнее бедренной артерии и бедренной вены. Снимок выполнен с использованием системы Aplio линейным датчиком с частотой 8-14 МГц (Toshiba Medical Systems, Tustin, CA). FA=femoral artery (бедренная артерия); FV=femoral vein (бедренная вена).
Венская группа продемонстрировала, что ультразвуковой контроль существенно улучшил интервал между проколом и обезболиванием и повысил качество сенсорного блока всех трех нервов, позволив при этом избегать таких осложнений, как случайный прокол артерии [37]. Мы также показали, что требуется вводить меньше местного анестетика, поскольку ультразвуковой контроль в отличие от нейростимуляции позволяет вводить его более точно [39].
Блокада поясничного отдела
Такой более централизованный доступ к поясничному сплетению также совместим с непосредственной ультразвуковой визуализацией. Предлагается огромное число вариантов доступа к поясничному отделу [4, 6, 49, 65], а также различных способов идентификации нервов [6, 49, 63]. Ни один из доступов не имеет степени успеха выше 70-80%, и все они включают риск серьезных осложнений [1, 44, 49].
В 2001 году Kirchmair и соавторы [31] сообщили о результатах использования постериальной паравертебральной сонографии для сопровождения блоков поясничного отдела под контролем ультразвука. При помощи конвексного ультразвукового датчика с частотой 5 МГц им удалось визуализировать у 20 добровольцев поясничную паравертебральную область, но не поясничное сплетение. В своем следующем исследовании они выполнили проколы в области поясничного отдела под ультразвуковым контролем у трупов, сопровождая их дополнительным КТ сканированием, и отметили, что иглу удалось точно ввести в поясничный отдел в 98% случаев [32].
Несмотря на кажущимися хорошими результаты, блоки поясничного отдела трудно осуществлять под ультразвуковым контролем, поскольку поясничное сплетение располагается относительно глубоко, на уровне поясничного отдела [5.5 (1.4) см на уровне L2/3; 5.5 (1.4) см на уровне L3/4; и 5.8 (1.3) см на уровне L4/5] [31]. Таким образом, качество ультразвуковой визуализации снижается, а ясные анатомические ориентиры не представлены. Также следует отметить, что игла должна быть ориентирована вдоль ультразвукового датчика. Для более подробной оценки потенциала ультразвукового контроля при блоках поясничного отдела требуется провести ряд дополнительных исследований.
Блокада седалищного нерва
Высокая степень успеха блоков седалищного нерва, составляющая 87-97% [5, 7, 43], по-видимому, связано с большими размерами этого нерва [17], что однако тоже повышает риск случайного прокола нерва. Ультразвуковой контроль позволяет снизить этот риск и повысить степень успеха почти до 100%. Субтотальная анестезия может быть следствием того, что седалищный нерв у 11% пациентов [2] разветвляется на большеберцовую и малоберцовую ветви на уровне подгрушевидного отверстия. Ультразвуковой контроль позволит анестезиологу увидеть это разделение и скорректировать процедуру таким образом, чтобы обе ветви были эффективно заблокированы. Также ультразвуковой контроль можно использовать для блокады заднего кожного нерва бедра, который является ветвью крестцового сплетения и иннервирует заднелатеральные сегменты бедра. Его невозможно блокировать традиционными средствами, поскольку он отделен от седалищного нерва на уровне проксимального отдела бедра.
При первых попытках увидеть седалищный нерв с помощью ультразвука возникали следующие проблемы. Во-первых, ультразвуковой луч следовало направлять перпендикулярно нерву в связи с его анизотропным характером. Нерв располагается между мыщцами, которые отфильтровывают высокие частоты, снижая, таким образом, качество изображения. Для визуализации нерва на всех уровнях вплоть до подколенной ямки подойдет линейный датчик с частотой 5-12 МГц. Прокол под контролем ультразвука стоит выполнять в подъягодичной области, поскольку в этом месте нерв расположен относительно близко к поверхности кожи (Рис.13).
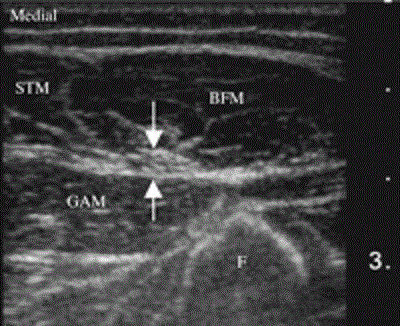
Рисунок 13 Поперечный вид седалищного нерва (обозначен стрелками) у 5-летнего ребенка на протяжении задней части верхней трети бедра между бицепсом бедра, полусухожильной и большой приводящей мышцами. Снимок выполнен с использованием системы Sonosite 180 Plus (Sonosite, Seattle, WA, USA) линейным датчиком с частотой 10 МГц. BFM=biceps femoris muscle (бицепс бедра); F=femur (бедренная кость); GAM=great adductor muscle (большая приводящая мышца); STM=semitendinous muscle (полусухожильная мышца).
Также можно выборочно визуализировать дистальные ветви седалищного и бедренного нервов, включая большеберцовый нерв на подколенном уровне и малоберцовый нерв, расположенный дистально по отношению к головке малоберцовой кости. Кроме того, высокочастотные линейные датчики позволяют визуализировать подкожные нервы, такие как медиальный икроножный кожный нерв (рядом с подкожной малой веной ноги) и подкожный нерв (терминальная сенсорная ветвь бедренного нерва рядом с подкожной большой веной ноги). Для оптимальной визуализации указанных поверхностных нервов необходимо использовать ультразвуковой гель.
Эпидуральная анестезия
Метод утраты сопротивления – это стандартный подход для идентификации эпидурального пространства при выполнении эпидуральной анестезии. Несмотря на то, что этот метод используется давно, только 60% проколов удается выполнить успешно с первой попытки [9]. Если не брать во внимание персональный опыт анестезиолога, такой высокий процент неудач можно объяснить качеством анатомических ориентиров и позиционирование пациента. Таким образом, возможно, в тех случаях, когда возникают сложности с этими переменными, проще было бы определить эпидуральное пространство с помощью ультразвука.
Grau и соавторы в ряде исследований продемонстрировали пользу этого подхода. Они были первыми, кто визуализировал эпидуральное пространство поясничного отдела у беременных женщин, поскольку выполнение прокола у этой группы пациента затруднено в связи с увеличенным весом, отеками и снижением эластичности коллагеновых волокон [18]. В следующем исследовании они преуспели в идентификации с помощью ультрасонографии [19] всех значимых ориентиров в эпидуральном пространстве грудного отдела.
Качество изображений, приведенных в упомянутых выше работах, было низким. Также следует отметить, что эти исследования не включали в себя использование ультразвука собственно для сопровождения прокола в режиме реального времени, с помощью ультразвука только определяли местонахождение анатомических ориентиров и оценивали глубину прокола. Однако даже такое «оффлайновое» применение позволило существенно сократить число попыток прокола (1.3 (0.6) против 2.2 (1.1) попыток) [20]. Во всех этих исследованиях Grau и соавторы использовали конвексный датчик с частотой 5 МГц и комбинировали поперечное и продольное сканирование.
Потенциал прокола эпидурального пространства под контролем ультразвука отчасти ограничивается помехами в виде костных структур и относительно глубокого расположения эпидурального пространства, что снижает качество получаемых изображений. Необходимо провести новые исследования для определения пользы ультразвукового контроля при выполнении эпидуральной анестезии.
Показания для обезболивания
Ультразвук оказался прекрасным средством для контроля блокад отдельных ганглиев и нервов при инвазивном обезболивании. Результаты выполнения симпатической поясничной блокады и блока солнечного сплетения под ультразвуковым контролем и под контролем КТ [16, 33] оказались сходными. Ультразвук полезен при мониторинге места прокола, постановке иглы и для контроля за распределением местного анестетика при блокаде звездчатого ганглия [27]. Более того, предположительно ультразвук может повысить безопасность этих методик за счет устранения риска случайного внутрисосудистого или субдурального ввода местного анестетика [28].
Новый, основанный на использовании ультразвука, доступ к блокаде фасеточных нервов был разработан и протестирован на трупах, добровольцах и пациентах [23]. В прошлом единственным способом диагностировать и лечить фасетный синдром, традиционную причину боли в пояснично-крестцовой области была блокада поясничного фасеточного нерва под контролем рентгеноскопии или КТ-сканирования. Новый подход, разработанный с применением ультразвукового контроля, значительно проще и полностью исключает радиоактивное облучение.
В работах, включающих применение ультразвукового контроля разрабатывается также цервикальная фасеточная блокада и несколько других типов лечения острой и хронической боли. Предварительные результаты этих исследований обнадеживают. Все разультаты, полученные к настоящему моменту подтверждают огромный потенциал ультразвукового контроля в инвазивном обезболивании.
Предварительный опыт применения у детей
В связи с тем, что регионарная анестезия у детей проводится под общим наркозом, высок риск того, что повреждения нервов могут остаться незамеченными [25]. Таким образом, ультразвук выглядит особенно привлекательным средством при работе с данной группой пациентов. Он подходит для работы при выполнении большинства блокад нервов и позволяет избежать серьезных осложнений, таких как случайный прокол толстой кишки при выполнении блокады подвздошно-пахового нерва [24] или прокол кровеносных сосудов при блокадах периферических нервов. Однако для достижения наивысшего качества и безопасности ультразвукового контроля необходимы дизайны клинических исследований высокого качества, поскольку частота осложнений, связанных с блокадами нервов у педиатрических пациентов очень низкая [15].
Для работы с детьми подойдут высокочастотные линейные ультразвуковые датчики (с частотой 10 МГц и выше), поскольку нервы расположены очень близко к поверхности кожи. В каждодневной практике мы используем ультразвуковой контроль при выполнении блокады подвздошно-пахового нерва, блоков нервов нижних конечностей (три-в-одном, седалищного нерва и подколенного) и блокады плечевого нервного сплетения. Подвздошно-паховый нерв можно увидеть с помощью ультразвука медиальнее верхней передней подвздошной ости между внешней и внутренней косыми мышцами живота (Рис.14).
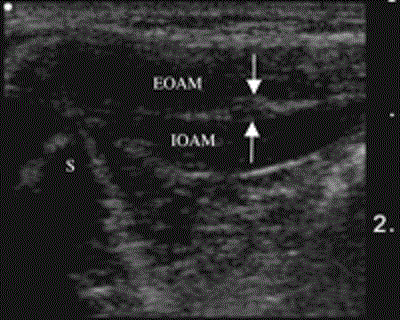
Рисунок 14 Поперечный вид подвздошно-пахового нерва (обозначен стрелками) медиальнее верхней передней подвздошной ости (S= anterior superior iliac spine) между внешней и внутренней косыми мышцами живота (EOAM=external oblique abdominal muscle; IOAM=internal oblique abdominal muscle). Снимок выполнен с использованием системы Sonosite 180 Plus линейным датчиком с частотой 10 МГц.
Небольшого количества местного анестетика будет достаточно для обеспечения периоперационного обезболивания в хирургии. Несмотря на популярность этой методики, степень ее успеха при выполнении вслепую очень мала [55]. Значительно лучших результатов можно достичь при использовании ультразвукового контроля.
Напротив, ультразвуковой контроль при выполнении подключичного блока у педиатрических пациентов – общепринятая методика. Венска группа сравнила традиционный метод нейростимуляции, описанный Fleischmann и соавторами [12], с ультразвуковым контролем при выполнении латеральной подключичной блокады плечевого сплетения у детей при операциях на верхних конечностях [40]. Несмотря на высокое качество нейростимуляции, сонографический подход позволяет снизить болевые ощущения в момент прокола, исключив мышечные сокращения, вызываемые нейростимуляцией. Это позволяет существенно сократить интервал от прокола до результата, а также увеличить длительность блокады чувствительности.
Выводы
Прямая ультразвуковая визуализация существенно улучшает результат большинства методик в анестезии периферических нервов. С помощью ультрасонографии с высоким разрешением анестезиолог может визуализировать соответствующие нервные структуры при блокадах нервов верхних и нижних конечностей на всех уровнях. Такая прямая визуализация позволяет значительно повысить качество нервных блокад и избежать осложнений. Представляется, что использование ультразвука позволяет повысить качество не только традиционных блокад плечевого и поясничного нервных сплетений, но также и общеупотребительных методик, применяемых в инвазивном обезболивании, например, блокады звездчатого ганглия или фасеточного нерва. Необходимы дальнейшие исследования для решения вопроса, может ли ультрасонография повысить качество нейроаксиальных методик. Многообещающие результаты были получены при работе с детьми, у которых большая часть блокад проводится под влиянием седативных препаратов или под общим наркозом.
Выгоды от прямой визуализации определенной нервной структуры и мониторинг распределения местного анестетика весьма значительны. Также ультразвуковой мониторинг дает анестезиологу возможность изменить положение иглы в случае неправильного распределения местного анестетика. С учетом вышесказанного оправдано ожидать от анестезиологов, что они приобретут навыки по использованию ультразвука в клинической практике. Применение методики можно сделать экономичным, если использовать доступные сейчас портативные ультразвуковые системы с высокочастотными датчиками. Хочется надеяться, что появление таких портативных систем позволит ввести применение ультразвукового контроля при регионарной анестезии в ежедневную практику.
Библиография
1 Aida S, Takahashi H, Shimoji K. Renal subcapsular hematoma after lumbar plexus block. Anesthesiology 1996; 84: 452–5
2 Bergmann RA, Thompson SA, Afifi AK, Saadeh FA. Compendium of Human Anatomy Variation. Munchen: Urban and Schwarzenberg, 1988; 494–9
3 Buttner J, Kemmer A, Argo A. Axillare Blockade des Plexus brachialis. Reg Anaesth 1988; 11: 7–11
4 Buttner M. Kontinuierliche periphere Techniken zur Regionalanasthesie und Schmerztherapie—Obere und untere Extremitat. Bremen: Uni-Med, 1999; 124–8
5 Chang PC, Lang SA, Yip RW. Reevaluation of the sciatic nerve block. Reg Anesth 1993; 18: 18–23
6 Chayen D, Nathan H, Chayen M. The psoas compartment block. Anesthesiology 1976; 45: 95–9
7 Davies MJ, McGlade DP. One hundred sciatic nerve blocks: a comparison of localisation techniques. Anaesth Intensive Care 1993; 21: 76–8
8 De Andres J, Sala-Blanch X. Ultrasound in the practice of brachial plexus anesthesia. Reg Anesth Pain Med 2002; 27: 77–89
9 De Filho GR, Gomes HP, da Fonseca MH, Hoffman JC, Pederneiras SG, Garcia JH. Predictors of successful neuraxial block: a prospective study. Eur J Anaesthesiol 2002; 19: 447–51
10 Fanelli G,Casati A,GaranciniP,Torri G.Nerve stimulator andmultiple injection technique for upper and lower limb blockade: failure rate, patient acceptance, and neurologic complications. StudyGroup on Regional Anesthesia. Anesth Analg 1999; 88: 847–52
11 Fanelli G, Casati A, Beccaria P, Cappelleri G, Albertin A, Torri G. Interscalene brachial plexus anaesthesia with small volumes of ropivacaine 0.75%: effects of the injection technique an the onset time of nerve blockade. Eur J Anaesthesiol 2001; 18: 54–8
12 Fleischmann E, Marhofer P, Greher M, Waltl B, Sitzwohl C, Kapral S. Brachial plexus anaesthesia in children: lateral infraclavicular vs axillary approach. Paediatr Anaesth 2003, 13: 103–8
13 Fornage BD. Peripheral nerves of the extremity: imaging with ultrasound. Radiology 1988; 167: 179–82
14 Frerk CM. Palsy after femoral nerve block. Anaesthesia 1988; 43: 167–8
15 Giaufre E, Dalens B, Gombert A. Epidemiology and morbidity of regional anesthesia in children: a one-year prospective survey of the French-Language Society of Pediatric Anesthesiologists. Anesth Analg 1996; 83: 904–12
16 Gimenez A, Martinez-Noguera A, Donoso L, Catala E, Serra R. Percutaneous neurolysis of the celiac plexus via the anterior approach with sonographic guidance. Am J Roentgenol 1993; 161: 1061–3
17 Graif M, Seton A, Nerubai J, Horoszowski H, Itzchak Y. Sciatic nerve: sonographic evaluation and anatomic-pathologic considerations. Radiology 1991; 181: 405–8
18 Grau T, Leipold RW, Horter J, Conradi R, Martin E, Motsch J. The lumbar epidural space in pregancy: visualization by ultrasonography. Br J Anaesth 2001; 86: 798–804
19 Grau T, Leipold RW, Delorme S, Martin E, Motsch J. Ultrasound imaging of the thoracic epidural space. Reg Anaesth Pain Med 2002; 27: 200–6
20 Grau T, Leipold RW, Conradi R, Martin E, Motsch J. Efficacy of ultrasound imaging in obstetric epidural anesthesia. J Clin Anesth 2002; 14: 169–75
21 Greher M, Retzl G, Niel P, Kamholz L, Marhofer P, Kapral S. Ultrasonographic assessment of topographic anatomy in volunteers suggest a modification of the infraclavicular vertical brachial block. Br J Anaesth 2002; 88: 632–6
22 Greher M, Kapral S. Is regional anesthesia simply an exercise in applied sonoanatomy? Anesthesiology 2003; 99: 250–1
23 Greher M, Schabert G, Kamholz LP, et al. Ultrasound-guided facet nerve block: a sono-anatomical study of a new methodological approach. Anesthesiology 2004; in press
24 Johr M, Sossai R. Colonic puncture during ilioinguinal nerve block in a child. Anesth Analg 1999; 88: 1051–2
25 Johr M. Regionalanasthesie. In: Kinderanasthesie, 5th edn. Munchen: Urban and Fischer, 2001; 173–6
26 Kapral S, Krafft P, Eibenberger K, Fitzgerald R, Gosch M, Weinstabl C. Ultrasound-guided supraclavicular approach for regional anesthesia of the brachial plexus. Anesth Analg 1994; 78: 507–13
27 Kapral S, Krafft P, Gosch M, Fleischmann D, Weinstabl C. Ultrasound imaging for stellate ganglion block: direct visualization of puncture site and local anesthetic spread. a pilot study. Reg Anesth 1995; 20: 323–8
28 Kapral S, Krafft P, Gosch M, Fridrich P, Weinstabl C. Subdural, extra-arachnoid block as a complication of stellate ganglion block: documentation with ultrasound. Anasthesiol Intensivmed Notfallmed Schmerzther 1997; 32: 638–40
29 Kapral S, Jandrasits O, Schabernig C, et al. Lateral infraclavicular plexus block vs. axillary block for hand and forearm surgery. Acta Anaesthesiol Scand 1999; 43: 1047–52
30 Kilka HG, Geiger P, Mehrkens HH. Infraclavicular plexus blockade. A new method for anaesthesia of the upper extremity. An anatomical and clinical study. Anaesthesist 1995; 44: 339–44
31 Kirchmair L, Entner T, Wissel J, Moriggl B, Kapral S, Mitterschiffthaler G. A study of the paravertebral anatomy for ultrasound-guided posterior lumbar plexus block. Anesth Analg 2001; 93: 477–81
32 Kirchmair L, Entner T, Kapral S, Mitterschiffthaler G. Ultrasound guidance for the psoas compartment block: an imaging study. Anesth Analg 2002; 94: 706–10
33 Kirvela O, Svedstrom E, Lundbom N. Ultrasonic guidance of lumbar sympathetic and celiac plexus block: a new technique. Reg Anesth 1992; 17: 43–6
34 Koscielnak-Nielsen ZJ, Stens-Pedersen HL, Lippert FK. Readiness for surgery after axillary block: single or multiple injection techniques. Eur J Anaesthesiol 1997; 14: 164–71
35 La Grange P, Foster PA, Pretorius LK. Application of the Doppler ultrasound bloodflow detector in supraclavicular brachial plexus block. Br J Anaesth 1978; 50: 965–7
36 Mahoudeau G, Gaertner E, Launoy A, Ocquidant P, Loewenthal A. Interscalenic block: accidental catheterization of the epidural space. Ann Fr Anesth Reanim 1995; 14: 438–41
37 Marhofer P, Schrogendorfer K, Koinig H, Kapral S, Weinstabl C, Mayer N. Ultrasonographic guidance improves sensory block and onset time of three-in-one blocks. Anesth Analg 1997; 85: 854–7
38 Marhofer P, Schro? gendorfer K, Andel H, et al. Combined sciatic nerve—3 in 1 block in high risk patient. Anaesthesiol Intensivmed Notfallmed Schmerzther 1998; 33: 399–401
39 Marhofer P, Schrogendorfer K, Wallner T, Koinig H, Mayer N, Kapral S. Ultrasonographic guidance reduces the amount of local anesthetic for 3-in-1 blocks. Reg Anesth Pain Med 1998; 23: 584–8
40 Marhofer P, Greher M, Sitzwohl C, Kapral S. Ultrasonographic guidance for infraclavicular plexus anaesthesia in children. Anaesthesia 2004; 59: 642–6
41 Meier G, Bauereis C, Maurer H, Meier T. Interscalenare Plexusblockade: anatomische Voraussetzungen—anasthesiologische und operative Aspekte. Anaesthesist 2001; 50: 333–41
42 Meier G, Maurer H, Bauereis C. Axillary brachial plexus block. Anatomical investigations to improve radial nerve block. Anaesthesist 2003; 52: 535–9
43 Morris GF, Lang SA, Dust WN, Van der Wal M. The parasacral sciatic nerve block. Reg Anesth 1997; 22: 223–8
44 Muravchick S, Owens WD. An unusual complication of lumbosacral plexus block: a case report. Anesth Analg 1976; 55: 350–2
45 Neuburger M, Kaiser H, Rembold-Schuster I, Landes H. Vertical infraclavicular brachial-plexus blockade. A clinical study of reliability of a new method for plexus anesthesia of the upper extremity. Anaesthesist 1998; 47: 595–9
46 Neuburger M, Landes H, Kaiser H. Pneumothorax in vertical infraclavicular block of the brachial plexus. Review of a rare complication. Anaesthesist 2000; 49: 901–4
47 Neuburger M, Kaiser H, Ass B, Franke C, Maurer H. Vertical infraclavicular blockade of the brachial plexus (VIP). A modified method to verify the puncture under consideration of the risk of pneumothorax. Anaesthesist 2003; 52: 619–24
48 Niesel HC. Beinnervenblockaden. In: Regionalanasthesie, Lokalanasthesie, Regionale Schmerztherapie. Stuttgart: Georg Thieme, 1994; 429–42
49 Parkinson SK, Mueller JB, Little WL, Bailey SL. Extent of blockade with various approaches to the lumbar plexus. Anesth Analg 1989; 68: 243–8
50 Perlas A, Chan VWS, Simons M. Brachial plexus examination and localization using ultrasound and electrical stimulation—a volunteer study. Anesthesiology 2003; 99: 429–35
51 Peterson MK. Ultrasound-guided nerve blocks. Br J Anaesth 2002; 88: 621–4
52 Retzl G, Kapral S, Greher M, Mauritz W. Ultrasonographic findings of the axillary part of the brachial plexus. Anesth Analg 2001; 92: 1271–5
53 Rosario DJ, Jacob S, Luntley J, Skinner PP, Raftery AT. Mechanism of femoral nerve palsy complicating percutaneous ilioinguinal field block. Br J Anaesth 1997; 78: 314–6
54 Sandhu NS, Capal LM. Ultrasound-guided infraclavicular brachial plexus block. Br J Anaesth 2002; 89: 254–9
55 Splinter WM, Bass J, Komocar L. Regional anaesthesia for hernia repair in children: local vs caudal anaesthesia. Can J Anaesth 1995; 42: 197–200
56 Stark RH. Neurologic injury from axillary block anesthesia. J Hand Surg 1996; 21: 391–6
57 Steiner E, Nas?el C. Sonography of peripheral nerves: basic principles. Acta Anaesthesiol Scand 1998; 42 (Suppl. 112): 46–8
58 Tetzlaff JE, Yoon HJ, Brems J. Interscalene brachial plexus block for shoulder surgery. Reg Anesth 1994; 19: 339–43
59 Tetzlaff JE, Yoon HJ, Dilger J, Brems J. Subdural anesthesia as a complication of an interscalene brachial plexus block. Case report. Reg Anesth 1994; 19: 357–9
60 Thierney E, Lewis G, Hurtig JB, Johnson D. Femoral nerve block with bupivacaine 0.25 per cent for postoperative analgesia after open knee surgery. Can J Anaesth 1987; 34: 455–8
61 Thompson GE, Rorie DK. Functional anatomy of the brachial plexus sheath. Anesthesiology 1983; 59: 117–22
62 Williams SR, Chovinard P, Arcand G, et al. Ultrasound guidance speeds execution and improves the quality of supraclavicular block. Anesth Analg 2003; 97: 1518–23
63 Winnie AP. The interscalene brachial plexus block. Anesth Analg 1970; 49: 455–66
64 Winnie AP, Ramamurthy S, Durrany Z. The inguinal paravascular technic of lumbar plexus anesthesia: the 3-in-1 block. Anesth Analg 1973; 52: 989–96
65 Winnie AP, Ramamurthy S, Durrani Z, Radonjic R. Plexus blocks for lower extremity surgery. Anesthesiol Rev 1974; 1: 11–6
66 Wu TJ, Lin SY, Liu CC, Chang HC, Lin CC. Ultrasound imaging aids infraclavicular brachial plexus block. Ma Zui Xue Za Zhi 1993; 31: 83–664 Winnie AP, Ramamurthy S, Durrany Z. The inguinal paravascular technic of lumbar plexus anesthesia: the 3-in-1 block. Anesth Analg 1973; 52: 989–9627 Kapral S, Krafft P, Gosch M, Fleischmann D, Weinstabl C. Ultrasound imaging for stellate ganglion block: direct visualization of puncture site and local anesthetic spread. a pilot study. Reg Anesth 1995; 20: 323–8 /