Ключевые слова: Аппарат искусственного кровообращения (АИК); Мелатонин; Перепады настроения; Операция на сердце.
___________________________________
Сокращения: ИМТ, индекс массы тела; Дельта, разница в уровне дневного и ночного мелатонина; HADS, госпитальная шкала тревоги и депрессии; АИК, аппарат искусственного кровообращения; ОРИТ, отделение реанимации и интенсивной терапии; без АИК, операции, проводимые без использования аппарата искусственного кровообращения; SAPS, упрощенная шкала острых физиологических изменений.
* Исследование полностью финансировалось фондами института.
** Автор, отвечающий за переписку. Адрес: Kardiologie, Kantonsspital Luzern, 6001 Luzern, Switzerland. Tel.: +41 41 205 51 06; fax: +41 41 205 22 34.
E-mail: Адрес электронной почты защищен от спам-ботов. Для просмотра адреса в вашем браузере должен быть включен Javascript. (P. Erne).
1010-7940/$ — см. Заголовок © Европейская Ассоциация Кардиоторакальной Хирургии. Опубликовано Elsevier B.V. Все права защищены.
doi:10.1016/j.ejcts.2008.03.035
1. Введение
В работах, в которых изучались разнообразные отдельные аспекты системы суточного ритма, зафиксированы соответствующие изменения в регуляции выработки мелатонина в послеоперационный период [1-3]. Мелатонин синтезируется пинеалоцитами в супрахиазматическом ядре в соответствии с суточной характеристикой. В то время как дневной яркий свет снижает выработку мелатонина, концентрации мелатонина в плазме в темноте быстро повышается и достигает пика в ночное время. При соблюдении режима мелатонин оказывает влияние на такие не жизненно важные функции, как регуляция сна, характер пробуждения, температура тела и изменение настроения и внимания [4]. Впрочем, роль мелатонина в стрессовых ситуациях не изучена до конца и может быть недооценена. Мелатонин может самостоятельно вызывать повышение интерлейкина 2,6 и 8, ФНО-альфа и интерферона-гамма и таким образом противостоять стрессу, связанному с подавлением иммунитета и гипотетически даже усугублять воспалительную реакцию [5,6]. У больных в критическом состоянии устойчивая кривая уровней дневного-ночного мелатонина, судя по всему, была тесно связана с коротким периодом, проведенным в отделении интенсивной терапии (ОРИТ) и более хорошим прогнозом [7]. Более того, психическое расстройство, связанное с пребыванием в ОРИТ, наблюдалось чаще, когда нормальный суточный уровень мелатонина был нарушен [3]. Систематически обнаруживалась взаимосвязь между нормальным уровнем мелатонина и перепадами настроения, в особенности, сезонной депрессией [8]. Следует отметить, что состояния депрессии и тревоги оказались важными предвестниками будущих сердечно-сосудистых патологий.
Одним из наиболее горячо обсуждаемых и поляризующих аспектов в кардиохирургии можно назвать вопрос, является ли аортокоронарное шунтирование с использованием АИК второстепенным по отношению к аортокоронарному шунтированию, проводимому без помощи аппарата искусственного кровообращения. Несмотря на то, что широкомасштабное рандомизированное проспективное исследование отсутствует, собран обширный массив данных, в соответствии с которыми ранее восстановление сознания после наркоза при втором варианте представляется менее благоприятным [10,11]. Этот период после обширного хирургического вмешательства характеризуется реакцией организма в виде эндокринно-метаболического и воспалительного хирургического стресса, включающего нарушения сна и суточного ритма, которые в свою очередь могут быть, хотя бы отчасти, следствием использования аппарата искусственного кровообращения [10,11]. В ходе одного небольшого исследования, включавшем 11 пациентов, был обнаружен низкий уровень мелатонина в плазме у пациентов, подвергавшихся аортокоронарному шунтированию с использованием АИК, но, к сожалению, исследователи не описали ни исходное состояние пациентов, ни контрольную группу [12].
2. Методы и материалы
Это рандомизированное проспективное исследование. В настоящем исследовании рассматривались уровни мелатонина до и после хирургического вмешательства (концентрация 6-сульфатоксимелатонина в моче) и изменения настроения (в соответствии с Госпитальной шкалой тревоги и депрессии (HADS)) у пациентов, подвергавшихся кардиохирургическим операциям с использованием аппарата искусственного кровообращения (АИК) и у пациентов специально подобранной группы, подвергавшихся обширным оперативным вмешательствам без использования АИК. Основные конечные показатели представляли собой изменения послеоперационного уровня мелатонина по сравнению с исходными данными (отражено в виде дельты между дневным и ночным уровнем). Вторичными конечными показателями стали изменения в психологической оценке, полученный с помощью стандартизированного анкетирования пациентов.
2.1 Протокол исследования
Пациенты, которым планировалось провести кардиоторакальную хирургическую операцию с использованием аппарата искусственного кровообращения, и пациенты, которым была назначена обширная полостная операция, требующая послеоперационного нахождения в отделении интенсивной терапии, были набраны для участия в исследовании в Люцернской кантональной больнице, Швейцария в период с августа 2006 года по февраль 2007 года. Условиями приема для участия в клиническом исследовании были возраст 30-80 лет и минимальный срок нахождения в больнице, равный 5 дням. Критериями исключения были (1) черепно-мозговая травма / операция на головном мозге, повлекшая разрушение шишковидного тела, (2) тяжелая почечная недостаточность (креатинин сыворотки крови >180 µmol/l), (3) нарушения функции печени (класс B и выше по Child–Pugh), (4) алкогольная зависимость и (5) прием антидепрессантов или других форм психиатрической помощи во время исследования. Каждый пациент дал письменное информационное согласие до включения в исследование. Исследование было одобрено местным комитетом по этике.
Накануне операции была собрана моча на анализ и произведена оценка уровня тревоги/ депрессии описанным ниже способом. Следующая порция мочи на анализ была собрана в день операции, когда это было возможно, либо на следующий день. Заключительный сбор мочи и второе психологическое тестирование осуществлялось в течение первых трех дней после перевода пациентов из ОРИТ в обычную палату. Регистрация основных жизненных показателей и заборы образцов крови осуществлялись одновременно со сбором мочи.
2.2 Измерение концентрации мелатонина
Период полураспада мелатонина в плазме составил в среднем 0,5-6 минут, после чего он быстро трансформировался в печени в 6-сульфатоксимелатонин. Этот весьма стабильный метаболит выделяется почками в неизмененном виде, и его концентрация тесно коррелирует с уровнями мелатонина в плазме [13]. Сбор мочи был спланирован в соответствии с параметрами дневного освещения. Первый сбор мочи на анализ осуществлялся за два часа до сумерек, чтобы оценить уровни концентрации мелатонина (дневной сбор). Затем мочу собрали спустя 2 часа после заката; результаты ночных измерений, выполнявшихся каждые 2 часа, все больше приближались к пиковым. Для каждого пациента время наступления сумерек (солнце на уровне 6? над горизонтом) было рассчитано индивидуально с учетом даты операции на основании данных общедоступной метеорологической системы (http://sunrisesunset.com). Для того чтобы иметь возможность осуществлять сбор мочи точно в определенное время, пациентам были установлены мочевые катетеры. Образцы мочи хранились при температуре -70?С, а 6-сульфатоксимелатонин измерялся посредством иммуноферментного анализа Buhlmann Laboratories (Альшвиль, Швейцария). Значения 6-сульфатоксимелатонина указаны в нг/мл.
2.3 Психологическая и физиологическая оценка
Госпитальная шкала тревоги и депрессии (HADS) была специально разработана для оценки уровня психологического стресса у госпитализированных пациентов и систематически подвергалась повторному утверждению [14]. Значение >11 принято считать показателем тревоги и депрессии. Анкеты заполнялись лично пациентами накануне операции. Повторное анкетирование было проведено на следующий день после последнего забора мочи. SAPS II (Simplified Acute Physiology Score II), упрощенная шкала острых физиологических изменений была создана, чтобы осуществлять единообразную оценку состояния тяжелобольных пациентов и для сравнивать пациентов, находящихся в разных медицинских учреждениях, а также для того, чтобы сделать на основании полученных баллов выводы о прогнозе и клиническом исходе [15]. В соответствии с общими требованиями, данные были собраны в первые 24 часа пребывания пациента в отделении ОРИТ и для всех параметров указывались самые худшие значения.
2.4 Статистический анализ
Статистический анализ выполнялся человеком, не осведомленным о типах операций, перенесенных пациентами, и последовательности измерений. Результаты представлены в виде средних значений и межквартильных размахов (interquartile range — разность между 75-м и 25-м процентилями), если не указано иное. Для сравнения межгрупповых и внутригрупповых различий применялись критерий знаковых рангов Уилкоксона и тест Манна-Уитни (пакет программ StatView 3.4, Abacus Concepts). Статистический уровень значимости результатов был определен как p < 0.05. Для расчета объема выборки мы приняли межгрупповую разницу в 40% как стандартное отклонение на 40% от среднего значения, а статистическую мощность равной 0.75
3. Результаты
3.1 Исходные характеристики
Для участия в исследовании были набраны 32 пациента, чей средний возраст равнялся 67 годам. Семнадцать пациентов (из них 6 женщин) подвергались хирургическому вмешательству с использованием АИК: пяти пациентам была произведена замена клапана сердца, восьми сделано аортокоронарное шунтирование, четверым – вмешательства на клапанном аппарате сердца в сочетании с коронарным шунтированием. Пятнадцать пациентов (из них 4 женщины) подвергались хирургическому вмешательству без использования аппарата искусственного кровообращения (группа без АИК): десяти пациентам были сделаны обширные полостные операции, четырем – торакальные вмешательства, одному пациенту осуществлена обширная хирургия головы и шеи. В целом показанием к хирургическому вмешательству у 8 пациентов из группы без АИК были злокачественные опухоли. Для пациентов обеих групп (АИК и без АИК) первый сбор мочи на анализ был осуществлен накануне операции, а сбор в послеоперационный период был в большинстве случаев (24 пациента) выполнен в день операции, либо на следующий после операции день (8 пациентов). Последний забор мочи для анализа выполнялся чаще всего на третий день после операции (межквартильный размах 2-й – 4-й день) и, соответственно, последняя оценка по шкале HADS осуществлялась на 4-й день. Исходные характеристики, включающие возраст, общие жизненные показатели и характер сна пациентов, были схожими (см. Таблицу 1).
Таблица 1
Исходные характеристики
| Пациенты с АИК (17 человек) |
Пациенты без АИК (15 человек) |
Значение p | |
| Возраст (лет) | 69 (65-76) | 65 (50-73) | 0.16 |
| Пол (женский / мужской) | 5/11 | 4/11 | 0.35 |
| Индекс массы тела (ИМТ) (кг/м2 | 28.0 (25.2-30.1) | 26.8 (24.7-30.6) | 0.92 |
| Среднее артериальное давление (мм.рт.ст.) | 97 (87-110) | 101 (93-106) | 0.92 |
| ЧСС (ударов в минуту) | 68 (60-75) | 70 (70-75) | 0.26 |
| Среднее время засыпания (час:мин) | 22:46 (22:23-23:26) | 22:49 (22:00-23:23) | 0.98 |
| Средняя продолжительность сна (часов) | 7:03 (6:30-8:00) | 7:53 (7:05-9:11) | 0.07 |
| Эпизоды пробуждения (кол-во) | 1.1 (0.4-1.6) | 1.3 (0-1.9) | 0.07 |
3.2 Периоперационные параметры
В целом средняя продолжительность госпитализации составила 11 дней, длительность операции – 3 часа 47 минут, период пребывания в ОРИТ после операции длился 44 часа, а период интубации – 13 часов. Несмотря на значительно большую длительность операции у пациентов из группы без АИК, общая длительность их госпитализации, пребывания в ОРИТ и периода интубации оказались короче, чем аналогичные периоды у пациентов группы с применением АИК. Физиологическая оценка, сделанная немедленно после операции с помощью шкалы SAPS (упрощенная шкала острых физиологических изменений), почти не отличается для пациентов обеих групп, указывая на схожую тяжесть заболеваний. Для получения полной картины сравнения двух групп см. Таблицу 2. В группе с использованием АИК продолжительность сердечно-легочного шунтирования составила 99 минут, а время пережатия аорты – 69 минут.
Таблица 2
Периоперационные показатели
| Пациенты с АИК (17 человек) |
Пациенты без АИК (15 человек) |
Значение p | |
| Госпитализация (дней) | 15 (10-17) | 10 (10-14) | 0.09 |
| Длительность операции (час: мин) | 3:45 (2:50-4:15) | 4:30 (3:02-6:55) | 0.04 |
| Период интубации (часов) | 16 (13-19) | 7 (5-9) | <0.01 |
| Пребывание в ОРИТ (часов) | 46 (26-96) | 24 (19-47) | 0.03 |
| Упрощенная шкала острых физиологических изменений SAPS (условные единицы) |
24 (17-31) | 20.5 (17-27) | 0.20 |
3.3 Мелатонин и психологическая оценка
Исходные (до операции) дневные и ночные показатели уровня 6-сульфатоксимелатонина были сопоставимы в обеих группах, включая пациентов группы без АИК, чьи результаты показали более неоднородное распределение (Рис. 1). При сравнении показателей пациентов с гипертензией (20 человек) и без гипертензии не было выявлено никаких различий (1.1 нг/мл (0-1.9) против 1.1 нг/мл (0.4-2.2), р=0.37). Непосредственно после завершения операции дельта между концентрацией мелатонина в дневной и ночной моче была в обеих группах близка к исходным значениям, что указывает на сохранность метаболизма мелатонина. В результате последнего измерения было выявлено сокращение или даже исчезновение дельты между концентрацией мелатонина в дневной и ночной моче (Рис. 2). Впрочем, послеоперационные изменения уровней мелатонина были весьма схожи у пациентов как группы с АИК, так и группы без АИК. Аналогичная тенденция наблюдалась при сравнении уровней мелатонина у пациентов со злокачественными опухолями и без них (исходные значения: 1.6 нг/мл (0-2.2), p=0.77; послеоперационные значения: 0.8 нг/мл (от -0.4 до 1.4), p=0.32; значения после перевода в палату: 0.1 нг/мл (от -0.4 до 1.1), p=0.53).
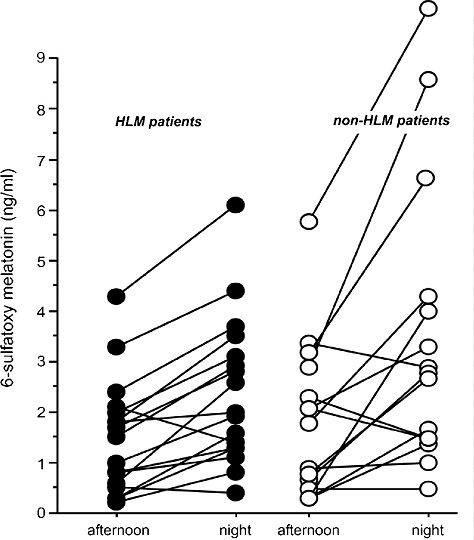
Рисунок 1. Исходные данные о концентрации мелатонина. Показатели уровня 6-сульфатоксимелатонина в моче до операции были сопоставимы в обеих группах. Средняя дневная (afternoon) концентрация мелатонина в моче составила 1.3 нг/мл (0.5-1.9) у пациентов группы с использованием АИК (на рисунке: HLM patients) и 1.6 нг/мл (0.6-2.2) у пациентов группы без АИК (на рисунке: non-HLM patients), p=0.89. Средняя ночная (night) концентрация мелатонина в моче составила 2.5 нг/мл (1.3-2.8) и 2.7 нг/мл (1.3-3.9) соответственно, p=0.44.
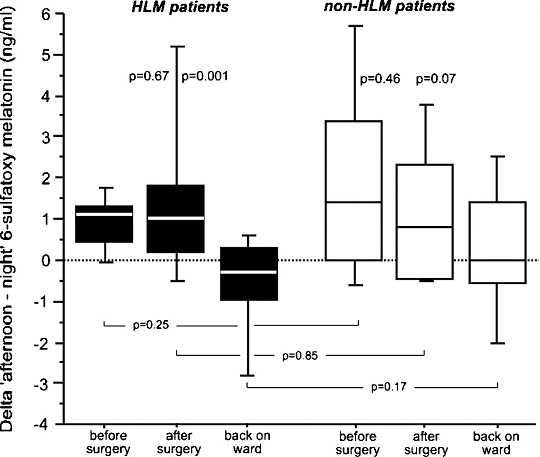
Рисунок 2. Дельты между дневным и ночным уровнями мелатонина. На этом рисунке сравниваются дельты между результатами дневных и ночных измерений концентрации мелатонина в моче. Пациенты группы с использованием АИК (на рисунке: HLM patients): не было выявлено никаких различий в результате измерений до (на рисунке: до операции – before surgery) и сразу после операции (на рисунке: after surgery) (1.1 нг/мл (0.5-1.3) против 1.0 нг/мл (0.3-1.8), p=0.67). Однако после возвращения в палату (на рисунке: back on ward) дельта между дневным и ночным уровнями полностью изменилась (-0.3 нг/мл (от -0.9 до 2.0), p=0.001). Для пациентов группы без АИК (на рисунке: non-HLM patients) события развивались по той же схеме: в результате измерений до и сразу после операции не было зафиксировано серьезных различий между дельтами (1.4 нг/мл (0.1-3.1) против 0.8 нг/мл (от -0.5 до 2.3), p=0.46), но было отмечено изменение в обратную сторону после возвращения обратно в палату (0.0 нг/мл (от -0.6 до 1.3), p=0.07). В результате межгруппового сравнения также не было замечено существенных изменений между дельтами (до операции p=0.25, после операции p=0.85 и после возвращения в палату p=0.17).
Исходная (до операции) психологическая оценка по шкале HADS не выявила разницы между пациентами двух групп (среднее значение в группе с АИК 8.0 (5.0-10.0), среднее значение в группе без АИК 7.0 (4.0-11.0), p=0.97); эти результаты говорят об отсутствии каких-либо значимых признаков депрессии или тревоги среди наших пациентов до операции. Индивидуальные результаты оценки настроения отражены на рисунке 3. Изменения среднего значения по шкале HADS были незначительными в группе с АИК (p=0.48) и группе без АИК (p=0.11), также не было зафиксировано межгрупповой разницы (p=0.33). У пациентов с ухудшившимися после операции показателями по шкале HADS (среднее значение 2.0) были замечены более серьезные изменения в суточной характеристике концентрации мелатонина в сравнении с пациентами, чьи значения по шкале HADS стали лучше (среднее значение -0.3), (Рис. 4). Мы не выявили связи между концентрацией мелатонина и полом, возрастом, кровяным давлением или ЧСС (данные не представлены).
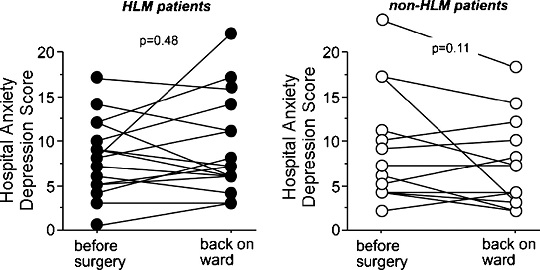
Рисунок 3. Перепады настроения до и после операции. У пациентов группы с использованием АИК (на рисунке: HLM patients) различия в оценке по госпитальной шкале тревоги и депрессии (HADS, условные единицы; на рисунке: Hospital Anxiety Depression Score) до операции (на рисунке: before surgery) и после возвращения в палату (на рисунке: back on ward) оказались незначительными (8.0 (5.0-10.0) против 7.0 (6.0-11.0), p=0.48). Аналогичные результаты показали измерения у пациентов группы без АИК (на рисунке: non-HLM patients) (7.0 (6.5-11.0) против 6.5 (3.5-8.8), p=0.11). Межгрупповое сравнение также не выявило существенных различий между двумя группами (исходное значение p=0.97, после возвращения в палату p=0.33).
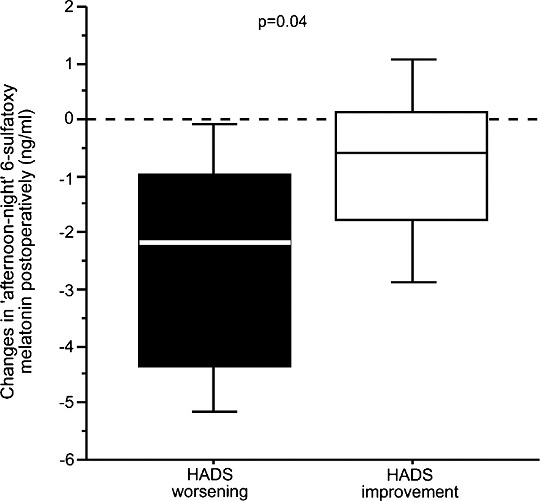
Рисунок 4. Взаимосвязь между изменениями концентрации мелатонина и перепадами настроения. На этом рисунке показано сравнение изменений в концентрации мелатонина у пациентов с улучшившимися (на рисунке: HADS improvement) или ухудшившимися (HADS worsening) показателями по госпитальной шкале тревоги и депрессии HADS после операции (2.0 (0.9-3.3) против -3.0 (от -4.1 до -2.0), p=0.001). Изменения в концентрации мелатонина рассчитывались в виде дельты дневного и ночного уровней концентрации мелатонина между результатами, полученными в отделении интенсивной терапии и после перевода в палату (пациенты с ухудшившимися показателями по шкале HADS -2/2 нг/мл (от -4.2до -1.1), пациенты с улучшившимися показателями по шкале HADS -0.6 нг/мл (от -1.3 до 0.2), p=0.04). Отрицательные значения указывают на снижение амплитуды между дневной и ночной концентрацией по сравнению с нормальной суточной характеристикой концентрации мелатонина. Полученные нами результаты позволяют предположить, что выработка мелатонина нарушается существеннее у пациентов с ухудшающимся HADS.
4. Обсуждение
В данном исследовании изучался вопрос о влиянии использования аппарата искусственного кровообращения на метаболизм мелатонина и перепады настроения. Пациенты, которым планировалось провести кардиоторакальную хирургическую операцию с использованием аппарата искусственного кровообращения, сравнивались с группой пациентов, которым была назначена обширная полостная операция без использования АИК. После операции нами были зафиксированы кардинальные изменения в суточной характеристике концентрации мелатонина, но различий между результатами двух изучаемых групп замечено не было. Характер изменений настроения был схожим у пациентов обеих групп как до, так и после проведения операции. Однако усугубление депрессии и тревоги было связано с серьезными изменениями концентрации мелатонина после операции. Мы сделали вывод, что у пациентов, подвергающихся крупной плановой торакальной операции, использование аппарата искусственного кровообращения при аортокоронарном шунтировании не оказывает существенного влияния ни на метаболизм мелатонина, ни на изменения в настроении.
Расстройства суточного ритма и перепады настроения оказывают большое влияние на количество послеоперационных осложнений и летальность. Как уже описывалось в литературе, изменения в суточной характеристике выработки мелатонина возникают в послеоперационный период [1-3]. Помимо собственно хирургического вмешательства, анестезиологических процедур, воспалительных процессов и отсутствие контакта с ярким светом во время общего наркоза может также приводить к изменениям в продукции мелатонина. Влияние экстракорпорального кровообращения, например, при использовании аппарата искусственного кровообращения при кардиоторакальной операции до сих пор не была адекватно освещено.
Исходные (до операции) уровни концентрации мелатонина в моче в нашем исследовании были несколько ниже значений, опубликованных для здоровых пациентов контрольной группы, однако соотношение между дневной и ночной концентрацией мелатонина было сопоставимым (разница приблизительно в три раза) [16, 17]. После операции мы зафиксировали кардинальные изменения концентрации мелатонина в моче в сторону выравнивания от нормального суточного мелатонинового профиля; однако изменения стали явными не сразу после операции, а на третий послеоперационный день, несмотря на длительный период операции (средняя продолжительность 3 часа 47 минут) и период искусственной вентиляции легких (12 часов 47 минут). Тот факт, что мы не обнаружили никаких изменений непосредственно после операции у пациентов группы с АИК соответствует результатам, полученным в исследовании, освещавшем искусственное кровообращение на терминальной стадии почечной недостаточности: концентрации мелатонина в сыворотке крови, поступающей в гемодиализатор и выходящей из него, оказались схожими [18]. Гуо (Guo) и коллеги, напротив, описывают снижение концентрации мелатонина в плазме ниже уровня обнаружения во время операции с использованием искусственного кровообращения; это понижение было временным и суточные характеристики быстро восстановились на второй послеоперационный день; к сожалению, в упомянутом исследовании отсутствует контрольная группа и не оценивались исходные (до операции) данные о концентрации мелатонина. В то время, как большинство авторов, включая нас, обнаружили соответствующее влияние операции на суточную характеристику концентрации мелатонина [1-3], другие исследования не смогли предоставить доказательство этого воздействия [19-20]. Можно утверждать, что возможные изменения могут зависеть от типов операций: Гёгенур [G?genur] и его коллеги, изучавшие пациентов, подвергавшихся обширным полостным операциям, аналогичным тем, которые осуществлялись пациентам нашей контрольной группы, также отметили изменения в метаболизме мелатонина, в то время, как Нишимура [Nishimura], наблюдавший пациентов, перенесших трансторакальную эзофагэктомию, не выявил никаких изменений [20]. Впрочем, наши результаты и данные, опубликованные ранее, не подтверждают связь между степенью оперативного вмешательства и изменениями в концентрациях мелатонина, поскольку изменения происходили как при незначительных (например, лапароскопическая холецистэктомия), так и при обширных абдоминальных и торакальных хирургических вмешательствах [21].
Насколько нам известно, послеоперационные нарушения настроения не оценивались одновременно с изучением суточных характеристик концентрации мелатонина. В то время как нарушения выработки мелатонина может быть связано с сезонной депрессией [8], знания о взаимосвязи между мелатонином и перепадами настроения, а также об изменениях в течение суток, при не психиатрических изначально заболеваниях весьма ограничены. В ранее опубликованном исследовании, изучавшем перепады настроения после аортокоронарного шунтирования, баллы по депрессии были максимальными через 2-3 дня после операции [22], что напоминает появление психических расстройств при психозе, развившемся в отделении интенсивной терапии, одновременно со сбоем суточной выработки мелатонина [3]. В нашем исследовании заключительная психологическая оценка была выполнена в среднем через 3 дня после операции, и в связи с этим мы считаем, что соответствующие изменения должны были быть обнаружены. В целом, мы не выявили никаких соответствующих изменений в оценке настроения с использованием шкалы HADS и сравнивая результаты до и после операции в обеих группах пациентов, несмотря на серьезные изменения в суточной характеристике концентрации мелатонина после операции. Наряду с полученными нами результатами, предоперационное применение мелатонина не снизило уровень тревоги у пожилых пациентов [23], а по данным другого исследования [24], несмотря на информацию о высоких концентрациях мелатонина у пациентов на терминальной стадии почечной недостаточности, связи с бессонницей, задержкой наступления сна или ночными пробуждениями выявлено не было. Интересно, что при сравнении пациентов с ухудшающимися результатами оценки по шкале HADS с теми, у кого произошло улучшение настроения после операции, у последних изменения в суточной характеристике концентрации мелатонина после операции оказались более существенными. Эти данные позволяют предполагать, что у некоторых людей нарушения концентрации мелатонина могут вызывать перепады настроения. Важно отметить, что тревога и депрессия оказались значимыми предвестниками будущих сердечно-сосудистых патологий [9].
4.1 Оговорки
Для контрольной группы мы отобрали пациентов, которым были назначены не кардиохирургические вмешательства. Мы исключили пациентов, которым осуществлялось аортокоронарное шунтирование без использования АИК, поскольку такие пациенты обычно моложе, им устанавливается меньше шунтов и длительность операции существенно короче. Таким образом, исключив вероятность искажения результатов, мы знаем, что между двумя группами могут существовать соответствующие различия, в частности, гипертензия и злокачественные опухоли [25, 26]. Но даже, несмотря на то, что мы не обнаружили соответствующих различий в выработке мелатонина у пациентов с гипертензией и злокачественными опухолями, мы не можем исключить вероятность ошибки, поскольку наше исследование не было рассчитано на выявление подобных различий.
Несмотря на то, что в нашем исследовании принимало участие наибольшее количество пациентов, в сравнении с другими исследованиями, рассматривающими метаболизм мелатонина в хирургии (Гуо (Guo) и коллеги: 12 пациентов; Гёгенур (G?genur) и коллеги: 11 пациентов; Каркела (Karkela) и коллеги: 20 пациентов), мы понимаем, что объем выборки ограничен, следовательно ошибка второго типа не может быть полностью исключена. Впрочем, возможность получения ложно нейтрального результата составляет всего около 5%.
4.2 Выводы
Несмотря на то, что в нашем исследовании принимало участие наибольшее количество пациентов, в сравнении с другими исследованиями, рассматривающими метаболизм мелатонина в хирургии (Гуо (Guo) и коллеги: 12 пациентов; Гёгенур (G?genur) и коллеги: 11 пациентов; Каркела (Karkela) и коллеги: 20 пациентов), мы понимаем, что объем выборки ограничен, следовательно ошибка второго типа не может быть полностью исключена. Впрочем, возможность получения ложно нейтрального результата составляет всего около 5%. 4.2 Выводы вызывающие озабоченность, по-прежнему остается частота послеоперационных осложнений. Влияние мелатонина пока остается спорным моментом. Результаты нашего исследования не отражают серьезного влияния аортокоронарного шунтирования с использованием АИК ни на метаболизм мелатонина, ни на перепады настроения после операции по сравнению с контрольной группой пациентов.
Благодарности
Мы выражаем признательность доктору Бригитте Мехманн (Dr. Brigitta Mehmann) за высококвалифицированные технические консультации и профессору Т.Ресинку (Professor Th. Resink) за рецензирование нашей рукописи. Мы благодарны за поддержку профессору П.Штульцу (Professor P. Stulz) и доктору Р.Шлае Длительность операции (час: мин)пферу (Dr. R. Schlaepfer) (отделение кардиоторакальной хирургии), профессору Дж. Метцгеру (Professor J. Metzger) (заведующий отделения висцеральнiой хирургии), доктору Ч.Хабертуру (Dr Ch. Haberthur) и доктору С.Элсассеру (Dr S. Elsasser) (заведующие отделения интенсивной терапии).
Библиография
[1] Cronin AJ, Keifer JC, Davies MF, King TS, Bixler EO. Melatonin secretion after surgery. Lancet 2000;356:1244—5.
[2] Gogenur I, Ocak U, Altunpinar O, Middleton B, Skene DJ, Rosenberg J. Disturbances in melatonin, cortisol and core body temperature rhythms after major surgery. World J Surg 2007;31:290—8.
[3] Miyazaki T, Kuwano H, Kato H, Ando H, Kimura H, Inose T, Ohno T, Suzuki M, Nakajima M, Manda R, Fukuchi M, Tsukada K. Correlation between serum melatonin circadian rhythm and intensive care unit psychosis after thoracic esophagectomy. Surgery 2003;133:662—p8.
[4] Brzezinski A.i Melatonin in24 (19-47) humans. N Engl J Med 1997;336:186—95.
[5] Carrillo-Vico A, Guerrero JM, Lardone PJ, Reiter RJ. A review of the multiple actions of melatonin on the immune system. Endocrine 2005;27:189—200.
[6] Maestroni GJ. The immunoneuroendocrine role of melatonin. J Pineal Res 1993;14:1—10.
[7] Olofsson K, Alling C, Lundberg D, Malmros C. Abolished circadian rhythm of melatonin secretion in sedated and artificially ventilated intensive care patients. Acta Anaesthesiol Scand 2004;48:679—84.
[8] Lieberman HR, Waldhauser F, Garfield G, Lynch HJ, Wurtman RJ. Effects of melatonin on human mood and performance. Brain Res 1984;323:201—7.
[9] Frasure-Smith N, Lesperance F. Depression and coronary artery disease. Herz 2006;31(Suppl. 3):64—8.
[10] Biglioli P, Cannata A, Alamanni F, Naliato M, Porqueddu M, Zanobini M, Tremoli E, Parolari A. Biological effects of off-pump vs. on-pump coronary artery surgery: focus on inflammation, hemostasis and oxidative stress. Eur J Cardiothorac Surg 2003;24:260—9.
[11] Sellke FW, DiMaio JM, Caplan LR, Ferguson TB, Gardner TJ, Hiratzka LF, Isselbacher EM, Lytle BW, Mack MJ, Murkin JM, Robbins RC. Comparingp onpump and off-pump coronary artery bypass grafting: numerous studies but few conclusions. Circulation 2005;111:2858—64.
[12] Guo X, Kuzumi E, Charman SC, Vuylsteke A. Perioperative melatonin secretion in patients undergoing coronary artery bypass grafting. Anesth Analg 2002;94:1085—91 [table of contents].
[13] Graham C, Cook MR, Kavet R, Sastre A, Smith DK. Prediction of nocturnal plasma melatonin from morning urinary measures. J Pineal Res 1998;24: 230—8.
[14] Aben I, Verhey F, Lousberg R, Lodder J, Honig A. Validity of the Beck depression inventory, hospital anxiety and depression scale, SCL-90, and Hamilton depression rating scale as screening instruments for depression in stroke patients. Psychosomatics 2002;43:386—93.
[15] Aegerter P, Boumendil A, Retbi A, Minvielle E, Dervaux B, Guidet B. SAPS II revisited. Intensive Care Med 2005;31:416—23.
[16] Mahlberg R, Tilmann A, Salewski L, Kunz D. Normative data on the daily profile of urinary 6-sulfatoxymelatonin in healthy subjects between the ages of 20 and 84. Psychoneuroendocrinology 2006;31:634—41.
[17] Paakkonen T, Makinen TM, Leppaluoto J, Vakkuri O, Rintamaki H, Palinkas LA, Hassi J. Urinary melatonin: a noninvasive method to follow human pineal function as studied in three experimental conditions. J Pineal Res 2006;40:110—5.
[18] Vaziri ND, Oveisi F, Wierszbiezki M, Shaw V, Sporty LD. Serum melatonin and 6-sulfatoxymelatonin in end-stage renal disease: effect of hemodialysis. Artif Organs 1993;17:764—9.
[19] Fassoulaki A, Kostopanagiotou G, Meletiou P, Chasiakos D, Markantonis S. No change in serum melatonin, or plasma beta-endorphin levels after sevoflurane anesthesia. J Clin Anesth 2007;19:120—4.
[20] Nishimura S, Fujino Y, Shimaoka M, Hagihira S, Taenaka N, Yoshiya I. Circadian secretion patterns of melatonin after major surgery. J Pineal Res 1998;25:73—7.
[21] Karkela J, Vakkuri O, Kaukinen S, Huang WQ, Pasanen M. The influence of anaesthesia and surgery on the circadian rhythm of melatonin. Acta Anaesthesiol Scand 2002;46:30—6.
[22] McCrone S, Lenz E, Tarzian A, Perkins S. Anxiety and depression: incidence and patterns in patients after coronary artery bypass graft surgery. Appl Nurs Res 2001;14:155—64.
[23] Capuzzo M, Zanardi B, Schiffino E, Buccoliero C, Gragnaniello D, Bianchi S, Alvisi R. Melatonin does not reduce anxiety more than placebo in the elderly undergoing surgery. Anesth Analg 2006;103:121—3 [table of contents].
[24] Ludemann P, Zwernemann S, Lerchl A. Clearance of melatonin and 6- sulfatoxymelatonin by hemodialysis in patients with end-stage renal disease. J Pineal Res 2001;31:222—7.
[25] Vician M, Zeman M, Herichova I, Jurani M, Blazicek P, Matis P. Melatonin content in plasma and large intestine of patients with colorectal carcinoma before and after surgery. J Pineal Res 1999;27:164—9.
[26] Cavallo A, Daniels SR, Dolan LM, Khoury JC, Bean JA. Blood pressure response to melatonin in type 1 diabetes. Pediatr Diab 2004;5:26—31.