Новая терапия септического шока на фоне некротического фасциита, вызванного β-‐ гемолитическим стрептококком, с помощью адсорбции цитокинов
Губерт Хетц (Hubert Hetz)1, Райнхард Бергер (Reinhard Berger), Питер Рекнагель (Peter Recknagel)2, Хайнц Штельцер (Heinz Steltzer)
1 Отделение анестезиологии и интенсивной терапии, Больница скорой помощи «AUVA Meidling Emergency Hospital», Вена, Австрия
2 Центр интеграции исследований и терапии, Центр контроля и лечения сепсиса, Университетская больница г.Йена, Йена, Германия
ПРЕДПОСЫЛКИ
Экстракорпоральные методики очистки крови привлекают все больше внимания как возможные вспомогательные методы терапии сепсиса и других воспалительных состояний, характеризующихся перепроизводством цитокинов. До настоящего времени в течение нескольких пилотных клинических исследований на человеке исследователи пытались применять для снижения уровня концентрации цитокинов неоптимизированные системы очистки крови (изначально разработанные для диализа и финальной стадии повреждения почек) (1). Из них небольшое преимущество для терапии некоторых аспектов септического поражения организма продемонстрировала только высокообъемная гемофильтрация (2,3). Основным недостатком большинства технологий очиcтки крови является их ограниченная возможность удалять цитокины из крови, что приводит к невозможности существенного снижения уровней концентрации цитокинов (4-‐6). К тому же, потребность в больших объемах замещающей жидкости делает эти технологии непрактичными. Гемоадсорбция с применением нового полимера (CytoSorb, представительство Cytosorbents Europe, Берлин, Германия), размещенного внутри картриджа для экстракорпоральной терапии, представляет собой многообещающую альтернативу как вспомогательное средство терапии пациентов с синдромом системного воспалительного ответа на фоне тяжелого сепсиса или септического шока. Полимер, содержащийся в CytoSorb, является одновременно высокоадсорбирующим и биосовместимым и дает возможность проводить зависимое от концентрации размеро - селективное удаление молекул среднего молекулярного веса (1-‐ 50 кДа). В настоящем документе мы даем отчет о случае септического шока на фоне некротического фасициита, вызванного β-‐ гемолитическим стрептококком, успешно излеченном с применением терапии CytoSorb. Одобрение комиссии по биомедицинской этике для настоящего исследования не требовалось, от пациента было получено информированное согласие.
ПРЕЗЕНТАЦИЯ КЛИНИЧЕСКОГО СЛУЧАЯ
60-‐летняя женщина без предшествующих заболеваний в анамнезе, кроме гипертензии и гипотериоза, поступила в медицинское учреждение в связи с переломом руки в результате несчастного случая. Неотложная помощь была оказана в виде наложения гипсовой лангеты, в тот же день провели хирургический остеосинтез. Через двое суток после операции был зарегистрирован отек и кровоточивость операционной раны. На следующие сутки отек заметно усилился и распространился выше по руке. Пульс на руке не прощупывался. Нужно отметить, что за 2 недели до несчастного случая пациентка перенесла стрептококковый фарингит. Пациентка потеряла сознание и была переведена в отделение интенсивной терапии (ОИТ). При поступлении были зарегистрированы следующие симптомы: температура тела 35.9°С, частота сердечных сокращений 120 уд./мин., частота дыхания 30, систолическое давление 70 мм рт.ст., что свидетельствовало о септическом шоке (19 баллов по шкале APACHE II и 8 баллов по шкале SOFA).
Безотлагательно была начата терапия антибиотиками (ампициллин, форсомицин), а также вазопрессорная и инфузионная поддержка (ранняя целенаправленная терапия). После хирургической фасциотомии, проведенной в те же сутки, наступила олигурическая фаза острого повреждения почек (общий диурез 300 мл/24 ч) и острый респираторный дистресс-‐синдром. Потребовалось начать постоянную вено-‐венозную гемофильтрацию и искусственную вентиляцию. Позже в течение дня был подтвержден β-‐ гемолитический стрептококк. Из-‐за быстрого распространения воспалительного ответа, подтвержденного концентрацией интерлейкина-‐6 (IL-‐6) на уровне 70 000 пг/мл, и потребности в почечно-‐заместительной терапии было принято решение использовать CytoSorb в качестве вспомогательной терапии. Стоит отметить, что время, прошедшее от первого взятия крови, измерения концентрации IL-‐6, информировании врача об уровне концентрации IL-‐6 (70 000 пг/мл), до установки и начала процедуры составило около 3 часов.
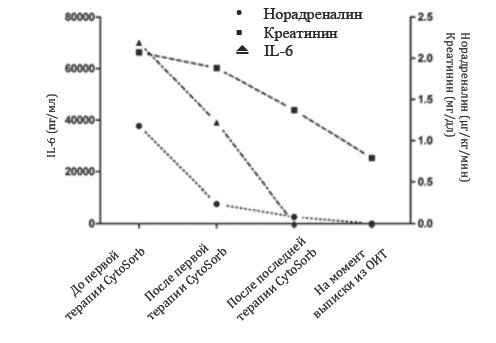
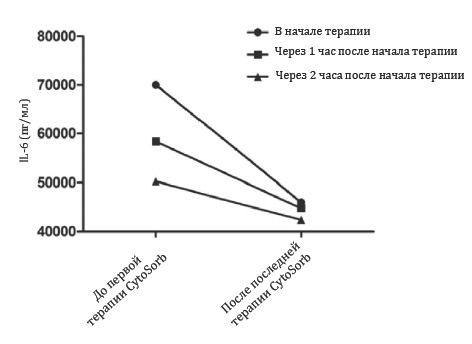
В общем за четверо суток было проведено три сессии терапии с помощью CytoSorb™ (система CytoSorb, CytoSorbents, Монмаут Джанкшн, штат Нью-‐Джерси, США) из расчета одна сессия в день с использованием одного картриджа для каждой сессии. Сессии терапии проводились в первые сутки, а также на третьи и четвертые сутки после поступления в ОИТ следующим образом: первая сессия – 36 часов, вторая сессия – 18 часов, третья сессия – 17 часов. После проведения первой сессии терапии поздним вечером при сдаче смены мы решили продолжить сессию и в следующие сутки, таким образом, длительность сессии достигла 36 часов, без каких-‐либо нежелательных эффектов, связанных с терапией. Сессии номер два и номер три проводились с нормальным интервалом в 17-‐18 часов. Терапия CytoSorb проводилась в комбинации со стандартным продолжительным гемодиализом (постоянный вено-‐венозный гемодиализ) (поток диализата 2000-‐2150 мл/ч, аппарат Fresenius Multifiltrate, компания Fresenius Medical Care, Бад Хомбург, Германия). В экстракорпоральном контуре выполнялась регионарная цитратная антикоагуляция, скорость кровотока достигала 100 мл/мин. Стоит отметить, что система CytoSorb размещалась в контуре перед гемофильтром аппарата постоянного вено-‐венозного гемодиализа. Маркеры воспаления, дисфункции органов и потребность в вазопрессорах в течение курса терапии подробно указана в Таблице I. После первой сессии концентрация интерлейкина-‐6 в плазме снизилась с 70 000 до 39 100 пг/мл (-‐ 44.3%). После третьей сессии терапии концентрация составляла 66 пг/мл (Рис. 1). Интересно отметить, что уровни IL-‐6, оцененные сразу после применения системы CytoSorb, были значительно ниже по сравнению с измеренными до начала терапии CytoSorb, что подтверждало эффективность работы системы (Рис.2). Более того, скорости удаления молекул явно зависели от их концентрации, что указывало на саморегуляционные свойства полимера (например, высокие концентрации цитокинов – высокая скорость удаления, низкие концентрации цитокинов – низкая скорость удаления).
Что важно, несмотря на значительно снижение уровней IL-‐6, энуклеация и последующее закрытие раны с помощью вакуумной терапии между второй и третьей сессией терапии CytoSorb были неизбежны. После третьей сессии терапии была продолжена гемофильтрация без применения CytoSorb, так как потребность в вазопрессорах значительно сократилась, а уровень концентрации IL-‐6 вернулся в пределы диапазона нормальных значений. Комбинация CytoSorb и постоянной вено-венозной гемодиафильтрации непрерывно продолжалась в течение 36 часов, нежелательных эффектов или событий, связанных с применением системы в течение и после терапии зарегистрировано не было. Общее состояния пациента улучшилось, и возможно стало провести экстубацию на четвертые сутки после третьей сессии терапии CytoSorb.
Таблица I ‐ МАРКЕРЫ ВОСПАЛЕНИЯ, ОРГАННОЙ ДИСФУНКЦИИ И ПОТРЕБНОСТЬ В ВАЗОПРЕССОРАХ 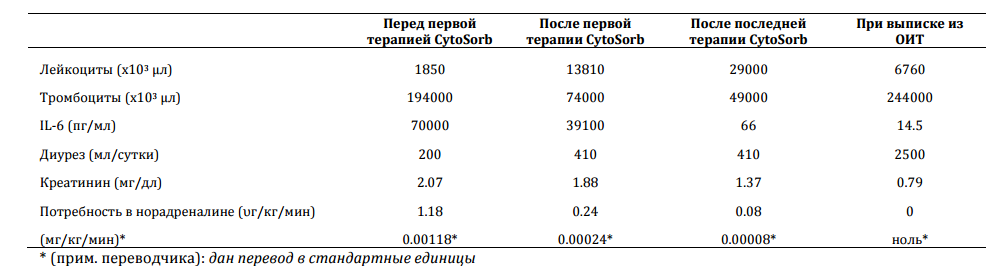
 |
 |
| Рис.1 -‐ Концентрации IL-‐6 и креатинина в плазме, а также потребность в норадреналине в течение 3 сессий терапии CytoSorb и во время выписки из ОИТ. |
Рис.2 – концентрация интерлейкина-6 в течение первой сессии терапии CytoSorb. Взятие образца крови для оценки концентрации IL-6 проводилось до и после применения системы CytoSorb. Высокие уровни цитокинов снижаются более эффективно, чем низкие уровни, что указывает на наличие у полимера саморегулирующих свойств. |
ВЫВОДЫ
Сепсис часто характеризуется чрезмерной продукцией цитокинов, что может привести к дальнейшей гибели клеток, повреждению органов и, в конечном итоге, полиорганной недостаточности и повлечь за собой летальный исход. При тяжелом сепсисе, при котором есть свидетельства дисфункции органов, уровень летальности достигает 60% - 80%. На настоящий момент, за исключением антибиозиса и контроля источника инфекции, специализированной терапии для сепсиса не существует, а лечение по большей части состоит из поддерживающих мер (гемодинамическая стабилизация, почечно-заместительная терапия, искусственная вентиляция), используемых по мере необходимости. Ранее предпринимались несколько попыток модуляции неконтролируемого иммунного ответа, задействующего несколько медиаторов (например, цитокины, хемокины, компоненты системы комплемента, фактор активации тромбоцитов, лейкотриены, тромбоксаны). Тем не менее, в результате сложной и многоликой структуры клинического сепсиса становится очевидным, что модуляция воспалительного ответа путем работы с одним только компонентом, таким как TNFα, IL-1RA или эндотоксином (и несмотря на многообещающие экспериментальные данные) в прошлом привело к провалу исследований или даже к печальным последствиям (9-11). Таким образом, технологии очистки крови, применяющие различные подходы (высокообъемная гемофильтрация, гемоадсорбция, комбинация фильтрации и адсорбции плазмы, мембраны для гемодиализа/гемофильтрации высокой плотности, с высоким пределом разделения по молекулярной массе) развиваются в сторону менее специфичных техник с более широким спектром действия, а также зависимых от концентрации методов удаления медиаторов воспаления. Несколько исследований на животных и предварительные данные клинического исследования применения CytoSorb для терапии пациентов с тяжелым сепсисом указывают на то, что гемоадсорбция с применением CytoSorb™ может быть полезной для снижении остроты воспалительного ответа во время сепсиса и может улучшить клинический исход. При эндотоксемии и интраабдоминальном полимикробном сепсисе, индуцированном перевязкой и пункцией слепой кишки, на крысиных моделях гемоадсорбция с применением CytoSorb позволила значительно снизить уровни концентрации ключевых цитокинов, таких как TNFα, IL-1β, IL-6 и IL-10, существенно улучшила гемодинамику и краткосрочную выживаемость (12,13). Что интересно, в долгосрочной перспективе (7 дней) на тех же моделях с сепсисом, индуцированном перевязкой и пункцией слепой кишки, терапия с помощью CytoSorb без прямого снижения уровней концентрации цитокинов в плазме крови позволила уменьшить степень повреждения органов и снизить летальность с 65% в контрольной группе до 40% в группе, где применялась система CytoSorb. Авторы пришли к выводу, что клиническая эффективность гемоадсорбции с применением CytoSorb задействует еще и другием механизмы, кроме снижения стандартно измеряемой концентрации цитокинов, таких как TNFα, IL-1β (14). Мы считаем нужным отметить, что животная модель, используемая Пенгом (Peng) и его коллегами, точно имитирует клиническую ситуацию, выявляемую у пациентов медицинских учреждений с явными признаками системного воспаления и полностью активированным цитокиновым ответом. Пациентка, терапия которой описана в настоящем отчете, в ранней пост-операционной фазе демонстрировала всеобъемлющую картину септического шока, подходящую под все критерии определения сепсиса. Несмотря на немедленное начало терапии антибиотиками, вазопрессорной и инфузионной поддержки, у пациентки развилась острая почечная недостаточность и острый респираторный дистресс-синдром, сопровождающийся массивным выбросом IL-6. Существуют доказательства того, что концентрации IL-6 в плазме отражают тяжесть состояния и являются маркерами клинического исхода (15-18). В дополнение нужно отметить, что не пиковый уровень как таковой, а сохранение уровня концентрации IL-6 в крови коррелирует со степенью тяжести и клиническим исходом (19). Из-за значительно повышенного уровня концентрации IL-6 и прогрессирующего ухудшения состояния пациента мы решили использовать систему CytoSorb, что в конечном итоге при вело к значительному ослаблению системного воспаления со снижением уровня концентрации IL-6 в плазме с 70 000 пг/мл до начала терапии CytoSorb до 66 пг/мл после последнего сеанса терапии. Несмотря на необходимость энуклеации, нам удалось стабилизировать пациентку на протяжении всего времени до хирургического контроля очага инфекции.
Мы не можем сказать, привело ли бы консервативное лечение (например, антибиотики, стабилизация гемодинамики с помощью вазопрессоров и объемной поддержки, контроль очага инфекции) к таким же результатам. Для проверки этого утверждения необходимо контролируемое исследование с подходящими пациентами, сравнивающее только консервативное лечение с комбинацией консервативного лечения и CytoSorb. Таким образом, ограничение настоящего исследования состоит в том, что случай, который мы описываем, не является репрезентативным, необходимо проведение дальнейших исследований. Тем не менее, в нашем случае, когда пациент демонстрировал картину выраженного септического шока, мы не хотели импровизировать и решили использовать комбинацию лучших терапевтических методов, доступных на сегодняшний день. Другим ограничением является то, что мы измеряли только уровень концентрации IL-6 как показателя магнитуды воспалительного ответа. В дальнейших исследованиях будет интересно проанализировать и другие медиаторы, участвующие в воспалительном ответе, для получения лучшего понимания эффективности процедуры и ведения терапии. Насколько нам известно, этот первый отчет о клиническом случае применения гемоадсорбции в комбинации с CytoSorb у пациента с тяжелым сепсисом и септическим шоком. Терапия хорошо переносилась пациентом, ее было возможно проводить в комбинации с постоянной вено- венозной гемодиафильтрацией и регионарной цитратной антикоагуляцией на постоянной основе в течение 36 часов без нежелательных эффектов. Гемоадсорбция с применением CytoSorb, таким образом, представляет собой многообещающую возможность для эффективного и безопасного лечения тяжелого сепсиса и септического шока.
Финансовая поддержка: Работа частично поддерживалась Наблюдательным медицинским советом.
Конфликт интересов: Ни один из авторов не имеет конфликта интересов, связанного с настоящим отчетом.
Адрес для корреспонденции: Проф. Хайнц Штельцер, дипломированный врач UKH Майлдинг (Meilding), Кундратштрассе (Kundratstrasse) 37 1120, Bена, Австрия
Адрес электронной почты: Адрес электронной почты защищен от спам-ботов. Для просмотра адреса в вашем браузере должен быть включен Javascript.
Ссылки
1. Риммеле Т. (Rimmele T), Келлум Дж.А. (Kellum JA). Клинический обзор: Очистка крови при сепсисе. Журнал “Интенсивная терапия” (Critical Care). 2011;15 (1):205. Опубликовано онлайн 16 февраля 2011 г.
2. Коул Л. (Cole L), Белломо Р. (Bellomo R), Журнуа Д. (Journois D), Дейвенпорт П. (Davenport P), Болдуин И. (Baldwin I), Типпинг П. (Tipping P). Высокообъемная гемофильтрация при септическом шоке у человека. Журнал “Медицина интенсивной терапии” (Intensive Care Medicine). 2001;27 (6):978-986.
3. Оноре П.М. (Honore PM), Джеймс Дж. (Jamez J), Ваутьер М. (Wauthier M), et al. Проспективная оценка влияния краткосрочной высокообъемной изоволемической гемофильтрации на гемодинамические параметры и клинический исход у пациентов с некупируемой недостаточностью кровообращения в результате септического шока. Журнал “Медицина критических состояний” (Critical Care Medicine). 2000;28(11):3581-3587.
4. Коул Л. (Cole L), Белломо Р. (Bellomo R), Харт Г. (Hart G), et al. Фаза II рандомизированного контролируемого исследования постоянной гемофильтрации при сепсисе. Журнал “Медицина критических состояний” (Critical Care Medicine). 2002;30 (1):100-106.
5. Паен Д. (Payen D), Матео Дж. (Mateo J), Кавайон Дж.-М. (Cavaillon JM), Фрэс Ф. (Fraisse F), Флориот Ц. (Floriot C), Вико Е. (Vicaut E); Группа «Гемофильтрация и сепсис» Национального колледжа реанимации и неотложной медицины не-университетских больниц (Hemofiltration and Sepsis Group of the College National de R.animation et de Medecine d’Urgence des Hospitaux extra-Universitaires) Влияние продолжительной вено-венозной гемофильтрации на отказ органов в ранней фазе тяжелого сепсиса: рандомизированное контролируемое исследование. Журнал “Медицина критических состояний” (Critical Care Medicine) 2009;37(3):803-810.
6. Хиринг П. (Heering P), Моргера С. (Morgera S). Шмитс Ф.-Дж. (Schmitz FJ) et al. Удаление цитокинов и сосудистая гемодинамика при постоянной вено-венозной гемофильтрации у больных. Журнал “Медицина интенсивной терапии” (Intensive Care Medicine). 1997;23 (3):288-296.
7. Ангус Д.-С. (Angus DC), Линди-Вирбл В.-Т. (LindeZwirble WT), Лидикер Дж. (Lidicker J), Клермонт Дж. (Clermont G), Карцилло Дж. (Carcillo J), Пински М.-Р. (Pinsky MR.) Эпидемиология тяжелого сепсиса в США: частота возникновения, клинический исход и цена лечения. Журнал “Медицина критических состояний” (Critical Care Medicine). 2001;29(7):1303-1310.
8. Енгель Ц. (Engel C), Брунхорст Ф.-М. (Brunkhorst FM), Боне Х.-Г (Bone HG), et al. Эпидемиология сепсиса в Германии: результаты национального проспективного многоцентрового исследования. Журнал “Медицина интенсивной терапии” (Intensive Care Medicine). 2007;33 (4):606-618.
9. Фишер Ц.-Дж. Младш. (Fisher CJ Jr.), Агости Дж.-М. (Agosti JM), Опал С.-М. (Opal SM), et al; Группа исследования рецептора растворимого TNFα при сепсисе. Терапия септического шока с помощью рецептора фактора некроза опухоли: гибридный белок Fc. Журнал «Медицинский журнал Новой Англии» (New England Journal of Medicine). 1996;334(26):1697-1702.
10. Абрахам Е. (Abraham E), Вундеринк Р. (Wunderink R), Сильверман Х. (Silverman H), et al. Эффективность и безопасность моноклональных антител к человеческому фактору некроза опухоли альфа у пациентов с сепсис- синдромом. Рандомизированное, контролируемое, двойное слепое многоцентровое клиническое исследование. Журнал группы исследования сепсиса TNF-alpha MAb. Журнал американской медицинской ассоциации (JAMA). 1995; 273(12):934-941.
11 Фишер Ц.-Дж. Младш. (Fisher CJ Jr.), Слотман Г.-Дж. (Slotman GJ), Опал С.-М. (Opal SM), et al; Группа изучения сепсиса IL-1RA. Первоначальная оценка человеческого рекомбинантного антагониста рецептора интерлейкина-1 в терапии сепсиса: рандомизированное открытое плацебо- контролируемое многоцентровое. Журнал “Медицина критических состояний” (Critical Care Medicine). 1994;22(1):12-21.
12. Пенг Ж.-Й. (Peng ZY), Картер М.-Дж. (Carter MJ), Келлум Дж.-А. (Kellum JA.). Эффективность гемоадсорбции для удаления цитокинов и кратковременной выживаемости крыс с сепсисом. Журнал “Медицина критических состояний” (Critical Care Medicine). 2008;36(5):1573-1577.
13. Келлум Дж.-А. (Kellum JA.), Сонг М. (Song M), Венкатараман Р. (Venkataraman R.). Гемоадсорбция удаляет фактор некроза опухолей, интерлейкин-6 и интерлейкин-10, снижает связывание ДНК с помощью ядерного фактора каппа-би и улучшает краткосрочную выживаемость при летальной эндотоксемии. Журнал “Медицина критических состояний” (Critical Care Medicine). 2004;32(3):801-805.
14. Пенг Ж-Й. (Peng ZY), Ванг Х-З. (Wang HZ), Картер М.- Дж. (Carter MJ), et al. Скоростное удаление общепринятых медиаторов сепсиса не объясняет эффективность экстракорпоральной очистки крови при экспериментальном сепсисе. Международный журнал «Почки» (Kidney Int). 2012;81(4):363-369.
15. Сплиттлер А. (Spittler A), Разенбергер М. (Razenberger M), Куппер Х. (Kupper H), et al. Соотношение концентрации интерлейкина-6 в плазме, фенотипа моноцитов, фагоцитарной функции моноцитов и продукцией цитокинов у пациентов с сепсисом. Журнал «Клинические инфекционные заболевания» (Clinical Infectuous Disease). 2000; 31(6):1338-1342.
16. Пенг Ж.-Й. (Peng ZY), Картер М.-Дж. (Carter MJ), Келлум Дж.-А. (Kellum JA.). Эффективность гемоадсорбции для удаления цитокинов и кратковременной выживаемости крыс с сепсисом. Журнал “Медицина критических состояний” (Critical Care Medicine). 2008;36(5):1573-1577.
17. Келлум Дж.-А. (Kellum JA), Лонг Л. (Long L), Финк М.-П. (Fink MP), et al; Исследователи, проводившие работу по изучению генетических и воспалительных маркеров сепсиса (GenIMS - Genetic and Inflammatory Markers of Sepsis). Понимание воспалительного цитокинового ответа при пневмонии и сепсисе у крыс: результаты исследования генетических и воспалительных маркеров сепсиса (GenIMS). Журнал «Архивы внутренней медицины» (Archives of Internal Medicine). 2007; 167(15):1655-1663.
18. Осучовски М.-Ф. (Osuchowski MF), Велч К. (Welch K), Сиддики Дж. (Siddiqui J), Ремик Д-Г. (Remick DG). Типы циркуляции цитокин/ингибитор меняют представление о континууме синдрома системного воспалительного ответа/компенсаторного противовоспалительного ответа при сепсисе и предсказывают летальность. Журнал «Иммунология» (Journal of Immunology). 2006; 177(3):1967-1974.
19. Пински М.-Р. (Pinsky MR), Винсент Дж.-Л. (Vincente JL), Девиер Дж. (Deviere J), Алегре М. (Alegre M), Кан Р.- Дж. (Khan RJ), Дюпонт Е. (Dupont E). Уровни цитокинов в сыворотке крови человека при септическом шоке. Отношение к полисистемной недостаточности органов и летальности. Журнал «Грудь» (Chest). 1993; 103(2):565-575.

