Эффективность воздействия новой системы гемоадсорбции цитокинов на воспалительный ответ при септическом шоке после резекции головки поджелудочной железы – отчет о клиническом случае
Томеску Д. 1,4 (Tomescu D.), Дима С.О. 2 (Dima SO), Танасеску С. 1 (Tânâsescu S.), Танасе С.П. 3 (Tânase CP), Настасе А. 2 (Nâstase A), Попеску М. 4 (Popescu M)
1 Отделение анестезиологии и интенсивной терапии III, Клиника Fundeni Clinical Institute, Бухарест, Румыния
2 Отделение общей хирургии и трансплантации печени, Клиника Fundeni Clinical Institute, Бухарест, Румыния
3 Университет “Titu Maiorescu”, медицинский факультет, Бухарест, Румыния
4 Университет медицины и фармакологии им. Карола Давила, Бухарест, Румыния
Журнал «Анестезия и интенсивная терапия» (Journal of Anaesthesia and Intensive Care) 2014;21 (2):134-‐138, Румыния
Краткий обзор
Тяжелый сепсис и септический шок ассоциируются с иммунным каскадом, который вызывает полиорганную недостаточность. На сегодняшний день не существует специализированной терапии, созданной специально для модуляции и ребалансировки уровней концентрации воспалительных цитокинов. Мы даем отчет о следующем клиническом случае: мужчина, 50 лет с постоперационным септическим шоком после резекции головки поджелудочной железы на фоне кистозной опухоли поджелудочной железы. Применение системы гемоадсорбции (CytoSorb®) во время продолжительной вено-‐венозной гемофильтрации ассоциируется со снижением концентрации фактора некроза опухолей альфа (TNFα), интерлейкина-‐1β (IL-‐1β), интерферона гамма (IFNΥ) и повышением уровня концентрации интерлейкина-‐10 (Измерения проводились до и после двух последовательных сессий терапии CytoSorb®). Эффективность применения системы CytoSorb® по удалению провоспалительных цитокинов проявляется в стабилизации гемодинамического профиля, сердечного выброса и нормализации индекса системного сосудистого сопротивления, а также сокращении потребности в вазопрессорной поддержке. Для определения показаний к применению системы CytoSorb® и оценки общего клинического исхода требуются дальнейшие проспективные клинические исследования.
Ключевые слова: сепсис, цитокины, CytoSorb, воспаление, гемодинамика, гемофильтрация, резекция головки поджелудочной железы, пробирный анализ xMAP
Введение
Тяжелый сепсис и септический шок ассоциируются с высокой летальностью и неблагоприятным клиническим исходом у послеоперационных пациентов [1], и, несмотря на последние достижения в области как хирургической, так и периоперационной медицинской помощи, летальность среди пациентов, перенёсших серьезную операцию на брюшной полости, остается высокой [2]. В клинической практике такие пациенты требуют нахождения в специализированном отделении интенсивной терапии и более дорогостоящего и длительного хирургического лечения, что делает исследования новых методов терапии сепсиса приоритетными среди реаниматологов.
Последние исследования в этой области [3-‐5] направлены на изучение иммунного каскада, сопровождающего сепсис, и путей ребалансировки воспалительного ответа. Сейчас принято считать, что воспаление при сепсисе является мультимодальным и начинается с синдрома системного воспалительного ответа (ССВО), характеризующегося высоким уровнем концентрации провоспалительных цитокинов, в особенности TNFα и интерлейкинов IL-‐1, IL-‐6. Их продукция балансируется производством противовоспалительных цитокинов, таких как IL-‐10. Эти процессы противостояния цитокинов известны как синдром смешанного антагонистического ответа (MARS) [6]. В исследованиях, изучающих терапевтические методы, предпринимались попытки модуляции ССВО в сторону более сбалансированной модели с высокой концентрацией противовоспалительных и низкой концентрацией провоспалительных цитокинов (компенсаторный противовоспалительный ответ (CARS), однако ни один из изучаемых методов не продемонстрировал преимущества [7‐8].
Колонки для гемоадсорбции, такие как CytoSorb®, могут помочь в лечении пациентов, устанавливая баланс между про-‐ и противовоспалительными цитокинами, не подавляя при этом иммунную систему. CytoSorb® -‐ экстракорпоральная система фильтрации цитокинов, которая может быть использована в комбинации с различными системами почечно-‐заместительной терапии. Система содержит биосовместимые пористые горошины полимера, способные удалять молекулы от 10 до 50 кДа (молекулярный вес большинства цитокинов). По этой причине CytoSorb® может удалять на 30-‐50% больше провоспалительных цитокинов, чем стандартная терапия, согласно исследованиям Шадлера (Schadler) et al [9].
Описание клинического случая
Мы даем отчет о следующем клиническом случае: мужчина, 50 лет, поступил в отделение ИТ на 5-‐ые сутки после резекции головки поджелудочной железы на фоне кистозной опухоли поджелудочной железы. У него зарегистрирована гипотензия, неврологическая дисфункция (12 баллов по шкале комы Глазго) и лактат-‐ацидоз. При поступлении в отделение интенсивной терапии у пациента обнаружилась афазия и правосторонний гемипарез. Была проведена экстренная компьютерная томография головного мозга, однако признаков острого инсульта не было обнаружено. Результаты лабораторных тестов показали повышение количества белых кровяных телец до 13560/мкл, С-‐реактивный белок на уровне 75.5 мг/л, прокальцитонин 0.529 нг/мл, повышенный уровень билирубина 7.6 мг/дл и лактатацидоз (pH = 7.12, избыток оснований, 8 ммоль/л и лактат 3.5 ммоль/л). Была безотлагательно начата терапия: инфузионная поддержка, антибиотики широкого спектра действия (меропенем, линезолид), а также противогрибковые препараты (флюконазол), гепарин, ингибиторы протонной помпы. Клиническое состояние пациента постепенно улучшалось в течение нескольких последующих дней за исключением неврологической дисфункции.
На 54-ый день нахождения в ОИТ был зарегистрирован острый воспалительный ответ: температура 40˚С, C-‐реактивный белок 390 мг/л, прокальцитонин 100 нг/мл. В связи с изменениями неврологического статуса (5 баллов по Шкале комы Глазго) и развития острого респираторного дистресс-‐ синдрома (ОРДС), двустороннего затемнения легких и PaO2/FiO2 140 (PaO2: парциальное давление кислорода в артериальной крови, FiO2: доля кислорода во вдыхаемом воздухе), пациент был интубирован и подключен к системе механической вентиляции легких. Был установлен катетер системы расширенного контроля гемодинамики (PiCCO Plus®) для учета гемодинамических показателей, начата вазопрессорная поддержка норадреналином в дозировке 4 мкг/кг/мин (среднее артериальное давление осталось на уровне <60 мм рт. ст., несмотря на адекватность инфузионной терапии). После постановки диагноза септический шок (шкала APACHE II -‐ 38 баллов и SOFA -‐ 15 баллов) была начата почечно-заместительная терапия (продолжительная вено-венозная гемофильтрация) в комбинации с системой CytoSorb® (представительство CytoSorbents Европа GmbH, Берлин, Германия) для нейтрализации острого повреждения почек и тяжелого лактатацидоза. Микробиологический анализ образца перитонеальной жидкости выявил инфекции Candida albicans и Klebsiella pneumoniale. В тот же день были назначены антибиотики и противогрибковые препараты (меропенем, колистин, флюконазол).
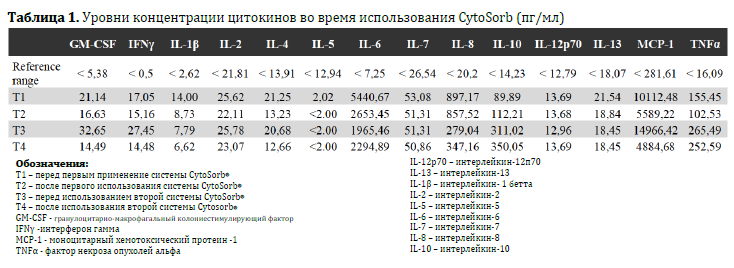
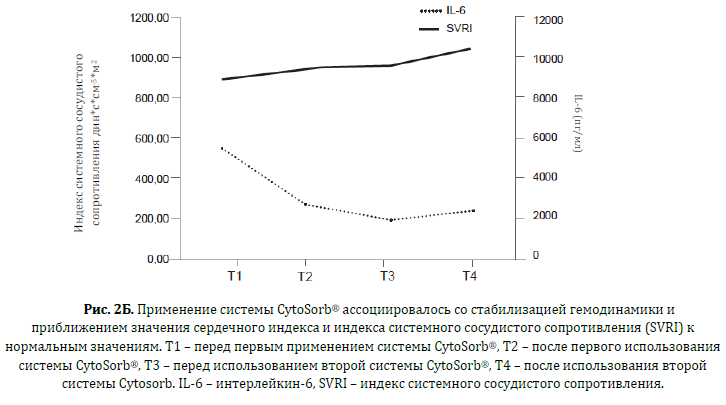
В общей сложности за 64 часа было проведено 2 последовательных сессии терапии CytoSorb® (24 часа каждая). Маркёры воспаления, параметры гемодинамики и уровень концентрации цитокинов в сыворотке замерялись до и после каждого сеанса терапии CytoSorb®. Уровни концентрации цитокинов определялись с помощью иммуно-‐ферментного анализа (иммуноферментный анализ на цитокины/хемокины человека, производство компании Merck Millipore, г.Биллерика, штат Масачусетс, США) на аппарате Luminex-‐200™ (производство компании Luminex, город Аустин, штат Техас), значения показателей показаны в Таблице 1. Система гемоадсорбции CytoSorb применялась в комбинации со стандартным аппаратом постоянной вено-‐венозной гемофильтрации Prismaflex® (производство компании Gumbro, г.Лунд, Швеция), антикоагуляция выполнялась с помощью гепарина. После каждой сессии терапии CytoSorb гемодинамика улучшалась: стабилизировался сердечный выброс (4.7 л/мин/м2), повысился индекс системного сосудистого сопротивления с 890 до 1040 дин*с*см-‐5*м2 и возможным стало снизить дозировку вазопрессоров с 4 до 0.4 мкг/кг/мин (Рисунки 2А и 2Б). Уровни маркёров воспаления также снизились: С-реактивный белок с 400 мг/л до 283 мг/л, прокальцитонин с 100 нг/мл до 46 нг/мл, количество белых кровяных телец упало с 16630/мкл до 10310/мкл (Рисунок 3).
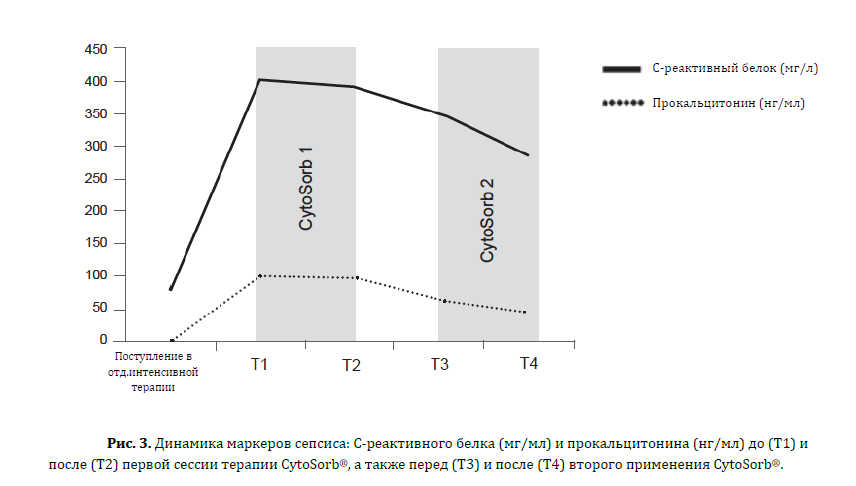
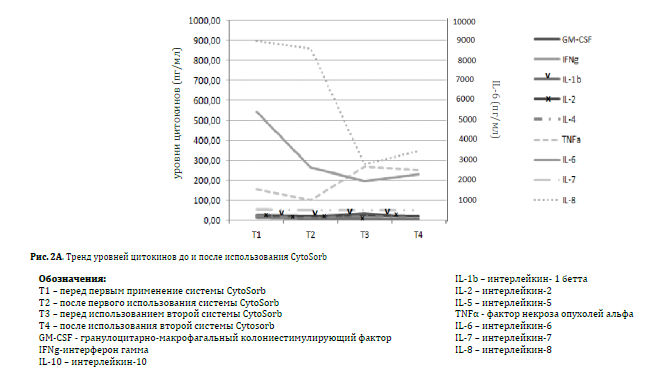
Клинический эффект, ассоциируемый с системой CytoSorb®, заключается в ребалансировке уровней концентрации цитокинов в крови. Мы наблюдаем снижение уровня концентрации провоспалительных цитокинов, в особенности IL-‐1β и TNFα, и рост уровня концентрации противовоспалительных цитокинов, в особенности IL-‐ 10 и IL-‐8. К тому же, было отмечено значительное снижение уровня концентрации интерферона гамма (IFNΥ). Снижение уровня лейкоцитов коррелировало с выраженным снижением как МСР-‐1 (моноцитарного хемоаттрактантного протеина-‐1), так и GM-‐CSF (гранулоцитарного макрофагального колониестимулирующего фактора).
Было принято решение о проведении хирургического контроля септического источника, однако пациент скончался в результате сердечной аритмии /фибрилляции желудочков (реанимационные меры не были успешными) через 24 часа после завершения второй сессии терапии CytoSorb®.
Обсуждение
Общеизвестно, что летальность от сепсиса наступает в результате чрезмерной продукции цитокинов, атакующих организм, и наступления полиорганной недостаточности. Восстановление баланса между производством про-‐ и противовоспалительных цитокинов во время иммунного ответа, ассоциированное с применением системы CytoSorb®, позволило стабилизировать гемодинамику и снизить уровень вазопрессорной поддержки. В нашем случае система CytoSorb снизила уровни концентрации провоспалительных цитокинов (в частности, IL-‐1β, IL-6 и МСР-‐1) и в то же время поддерживала высокий уровень противовоспалительных цитокинов (IL-‐10). Скорректированный таким образом во время и после терапии с применением CytoSorb® иммунный ответ, скорее всего, вызвал улучшение гемодинамики. Терапия CytoSorb® кажется более эффективной по сравнению с другими цитокин-‐ориентированными методиками, которые, будучи нацеленными только на один конкретный цитокин, не в состоянии ребалансировать процесс воспаления в целом.
В последней редакции «Руководящих принципов выживания при сепсисе» (Surviving Sepsis Campaign guidelines) [10] для терапии тяжелого сепсиса и септического шока рекомендуется использовать только инфузионную поддержку, антибиотики, контроль очага воспаления и поддерживающие меры (гемодинамическую оптимизацию). Рекомендации по модуляции иммунного ответа для минимизации или предотвращения повреждения органов во время начала цитокинового шторма отсутствуют. Терапия последующего повреждения органов заключается в проведении специализированных поддерживающих мероприятий. Исследования в области иммунологической модуляции и воспалительного ответа септических пациентов до настоящего времени были направлены только на конкретные цитокины [11], такие как TNFα и IL-‐1β. Во время проспективного контролируемого исследования [12] пациентов с сепсисом и острой почечной недостаточностью была предпринята попытка продемонстрировать эффективность почечно-‐заменительной терапии для контроля уровней концентрации цитокинов, в частности TNFα, однако достигнуть этого не удалось.
До этого момента еще ни одна специальная терапия для удаления цитокинов не доказала свои преимущества. Использование CytoSorb® на пациентах с тяжелым сепсисом и септическим шоком -‐ это новая область исследований с недостатком данных, требующая проведения крупных проспективных рандомизированных исследований. Тем не менее, клинические обзоры и небольшие клинические исследования, опубликованные ранее, показали многообещающие результаты. Хетц (Hetz) et al. [13] дали отчет о следующем клиническом случае: женщина с диагнозом септический шок и полиорганная недостаточность на фоне некротического фасциита. Успешно проведена терапия с применением продолжительной вено-венозной гемофильтрации и использованием системы CytoSorb®. Удалось снизить уровень концентрации цитокина IL-‐6 и улучшить состояние пациентки в ожидании хирургического контроля очага воспаления. Мицнер (Mitzner) et al [14] докладывали о случае 80-летнего пациента с пневмогенным септическим шоком. Через 24 часа продолжительной вено-венозной гемофильтрации с применением системы CytoSorb® потребность в вазопрессорной терапии резко снизилась, равно как и концентрация уровня IL-6, лейкоцитов и маркёров воспаления (С-‐реактивный белок, прокальцитонин). Небольшое проспективное клиническое исследование, проведенное Борн (Born) et al. [15], показало снижение уровня концентрации IL-6, C-‐реактивного белка и белых кровяных телец во время кардиохирургии с применением стандартного экстракорпорального кровообращения.
Заключение
В данном случае использование системы CytoSorb® в комбинации с продолжительной вено-венозной гемофильтрацией помогло восстановить баланс между про-‐ и противовоспалительными цитокинами, что привело к стабилизации гемодинамического профиля. Технология проста в использовании и работает в любыми аппаратами продолжительной вено-‐венозной гемофильтрации, терапия хорошо переносится пациентами и не имеет неблагоприятных эффектов. Время начала применения системы CytoSorb®, более ранее (сразу после начала синдрома системного воспалительного ответа) или отложенное (после наступления органной недостаточности), должно быть далее исследовано.
Ссылки
1. Vogel TR, Dombrovskiy VY, Carson JL, Graham AM, Lowry SF. Postoperative sepsis in the United States. Ann Surg 2010; 252: 1065-1071
2. Moore LJ, Moore FA, Todd SR, Jones SL, Turner KL, Bass BL. Sepsis in general surgery: the 2005-2007 national surgical quality improvement program perspective. Arch Surg 2010; 145: 695- 700
3. Aziz M, Jacob A, Yang WL, Matsuda A, Wang P. Current trends in inflammatory and immunomodulatory mediators in sepsis. J Leukoc Biol 2013; 93: 329-342
4. Hotchkiss RS, Monneret G, Payen D. Sepsis-induced immunosuppression: from cellular dysfunctions to immunotherapy. Nat Rev Immunol 2013; 13: 862-874
5. Venet F, Lukaszewicz AC, Payen D, Hotchkiss R, Monneret G. Monitoring the immune response in sepsis: a rational approach to administration of immunoadjuvant therapies. Curr Opin Immunol 2013; 25: 477-483
6. Oberholzer A, Oberholzer C, Moldawer LL. Sepsis syndromes: understanding the role of innate and acquired immunity. Shock 2001; 16: 83-96
7. Zisman DA, Kunkel SL, Strieter RM, Gauldie J, Tsai WC, Bramson J, et al. Anti-interleukin-12 therapy protects mice in lethal endotoxemia but impairs bacterial clearance in murine Escherichia coli peritoneal sepsis. Shock 1997; 8: 349-356
8. Fisher CJ, Dhainaut JFA, Opal SM, Pribble JP, Balk RA, Slotman GJ, et al. Recombinant human interleukin 1 receptor antagonist in the treatment of patients with sepsis syndrome. Results from a randomized, double-blind, placebo-controlled trial. JAMA, 1994; 271: 1836-1843
9. Schadler D, Porzelius C, Jörres A, Marx G, Meier-Hellmann A, Putensen C, et al. A multicenter randomized controlled study of an extracorporeal cytokine hemoadsorption device in septic patients. Crit Care 2013; 17(Suppl 2): P62
10. Dellinger RP, Levy MM, Rhodes A, Annane D, Gerlach H, Opal SM, et al. Surviving sepsis campaign: international guidelines for management of severe sepsis and septic shock: 2012. Intensive Care Med 2013; 39: 165-228
11. Abraham E, Wunderink R, Silverman H, Perl TM, Nasraway S, Levy H, et al. Efficacy and safety of monoclonal antibody to human tumor necrosis factor alpha in patients with sepsis syndrome. A randomized, controlled, double-blind, multicenter clinical trial. TNF-alpha MAb Sepsis Study Group. JAMA 1995;
12. Heering P, Morgera S, Schmitz FJ, Schmitz G, Willers R, Schultheiss HP, et al. Cytokine removal and cardiovascular hemodynamics in septic patients with continuous venovenous hemofiltration. Intensive Care Med 1997; 23: 288-296
13. Hetz H, Berger R, Recknagel P, Steltzer H. Septic shock secondary to β-hemolytic streptococcus-induced necrotizing fasciitis treated with a novel cytokine adsorption therapy. Int J Artif Organs 2014; 37: 422-426
14. Mitzner SR, Gloger M, Henschel J, Koball S. Improvement of hemodynamic and inflammatory parameters by combined hemoadsorption and hemodiafiltration in septic shock: a case report. Blood Purif 2013; 35: 314-315
15. Born F, Pichlmaier M, Peterss S, Khaladj N, Hagl C. Systemic Inflammatory Response Syndrome in heart surgery: New possibilities for treatment through the use of a cytokine adsorber during ECC?. Kardiotechnik 2014; 2

